微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 单质钛(Ti)的机械强度高,抗腐蚀能力强,有“未来金属”之称。以TiO2制金属钛,主要反应有:①TiO2+2C+2Cl2 TiCl4+2CO;②TiCl4+2Mg
TiCl4+2CO;②TiCl4+2Mg 2MgCl2+Ti下列叙述不正确的是( )
2MgCl2+Ti下列叙述不正确的是( )
A.反应①中碳是还原剂
B.反应①中TiO2是氧化剂
C.反应②表现了金属镁还原性比金属钛强
D.反应①中氧化剂与还原剂物质的量之比为1∶1
参考答案:B
本题解析:A、反应①中碳化合价升高,是还原剂;B、反应①中TiO2中无化合价的变化;C、反应②中镁将钛置换出来,故表现了金属镁还原性比金属钛强;D、反应①中氧化剂与还原剂物质的量之比为1∶1。
本题难度:一般
2、选择题 2.3g钠在干燥的空气中被氧化后,可得3.5g固体,因此可判断其氧化产物为( )
A.Na2O2
B.Na2O
C.Na2O和Na2O2
D.无法确定
参考答案:C
本题解析:略
本题难度:一般
3、填空题 (15分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1= a kJ?mol-1
CO(g) + H2O (g)=CO2(g) + H2 (g) ΔH2= b kJ?mol-1
2CO(g) + O2(g)=2CO2(g) ΔH3 = c kJ?mol-1
反应CO2(g) + CH4(g) 2CO(g) + 2H2(g) 的ΔH= kJ?mol-1。
2CO(g) + 2H2(g) 的ΔH= kJ?mol-1。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
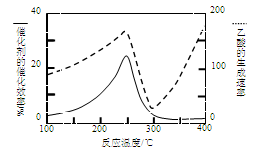
① 在不同温度下催化剂的催化效率与乙酸的生成速率如图8所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
② 为了提高该反应中CH4的转化率,可以采取的措施是 。
③ 将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)以CO2为原料可以合成多种物质。
① 利用FeO吸收CO2的化学方程式为:6FeO + CO2=2Fe3O4 + C,则反应中每生成1molFe3O4,转移电子的物质的量为 mol。
② 以氢氧化钾水溶液作电解质进行电解,在铜电极上CO2可转化为CH4,另一电极石墨连接电源的 极,则该电解反应的化学方程式为 。
参考答案:(15分,化学方程式缺条件或箭头只扣1分) (1) a+2b?2c (3分)
(2)①温度超过250℃时,催化剂的催化效率降低(2分)
② 增大反应压强或增大CO2的浓度(2分)
③ 3Cu2Al2O4+32H++2NO3-=6Cu2++ 6Al3++2NO↑+16H2O(2分) (3) ① 2(2分)
② 正(2分) CO2 + 2H2O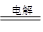 CH4 + 2O2(2分)
CH4 + 2O2(2分)
本题解析:(1)已知:① CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1= a kJ?mol-1,②CO(g) + H2O (g)=CO2(g) + H2 (g) ΔH2= b kJ?mol-1,③2CO(g) + O2(g)=2CO2(g) ΔH3 = c kJ?mol-1,则根据盖斯定律可知①+②×2—③×2即得到反应CO2(g) + CH4(g) 2CO(g) + 2H2(g) 的ΔH=a+2b?2ckJ?mol-1。
2CO(g) + 2H2(g) 的ΔH=a+2b?2ckJ?mol-1。
(2)①由于催化剂的催化效率受温度影响大,所以250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低。
②该反应是体积减小的可逆反应,所以为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度。
③硝酸是氧化性酸,稀硝酸的还原产物是NO,则根据电子得失守恒和原子守恒可知Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++ 6Al3++2NO↑+16 H2O。
(3)①根据方程式6FeO + CO2=2Fe3O4 + C可知反应中每生成1molFe3O4,消耗0.5molCO2。其中碳元素的化合价从+4价降低到0价,则转移电子的物质的量为2mol。
②铜是活性电极,如果在铜电极上CO2可转化为CH4,这说明铜电极是阴极,则另一电极石墨连接电源的正极,该电极是阳极,溶液中的氢氧根失去电子转化为氧气,则该电解反应的化学方程式为CO2 + 2H2O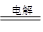 CH4 + 2O2。
CH4 + 2O2。
考点:考查盖斯定律、外界条件对平衡状态的影响、氧化还原反应以及电化学原理应用
本题难度:困难
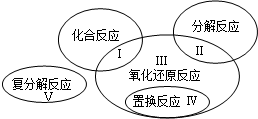
4、填空题 已知氧化还原反应与四种基本反应类型的关系可用如图表示,下列是有水参加或生成的几种反应:
①CaO+H2O =Ca(OH)2
②2Na+H2O=2NaOH+H2↑
③H2+CuO 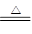 ?Cu +H2O
?Cu +H2O
④3S+6NaOH 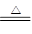 2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH+HCl=NaCl+H2O
请回答下列问题:
(1)反应①中水?(填字母)。
A.是氧化剂
B.是还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂