微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是(? )
A.同一元素不可能既表现金属性,又表现非金属性
B.氯化氢溶于水能导电,但液态氯化氢不能导电
C.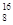 O、
O、 O和
O和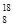 O互为同位素,均属于氧元素,且性质完全相同
O互为同位素,均属于氧元素,且性质完全相同
D.导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多
参考答案:B
本题解析:A:铝元素就既表现金属性,又表现非金属性
B:正确
C:同位素的物理性质不同
D:溶液导电性与溶液的浓度、溶质的电离程度、移动离子所带电荷多少均有关
答案为B
本题难度:简单
2、选择题 实际存在的11H、12H、13H 、H+和H2,它们是
A.氢的五种同位素
B.氢元素的五种不同微粒
C.氢的五种核素
D.五种氢元素
参考答案:B
本题解析:A、11H、12H、13H是同位素,后两种不是,错误;B、三种核素、离子和分子,五种不同微粒,正确;C、错误;D、均是由氢元素组成,错误。
本题难度:一般
3、填空题 (8分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)由这五种元素组成的一种化合物是(写化学式)__________________。
(2)写出C元素基态原子的电子排布式______________________________ 。
(3)用电子排布式表达式表示B元素原子的价电子构型_______________。
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是________________。(用元素符号和“﹥或﹤或﹦”表示)
(5)DB2是由?键构成的?(填“极性”或“非极性” )分子;
分子空间构型是?。
参考答案:(1)KAl(SO4)2?12H2O(1分)?(2)1s22s22p63s23p1 (1分)?(3)2s22p4 ?(1分)
(4)O>S? Al>K (2分)?(5)极性;极性; V型(3分)
本题解析:根据元素的结构及有关性质可知,A、B、C、D、E 5种元素分别是H、O、Al、S、K。
(1)由这五种元素组成的一种化合物应该是明矾,化学式为KAl(SO4)2?12H2O。
(2)根据构造原理可知,Al元素基态原子的电子排布式为1s22s22p63s23p1 。
(3)根据构造原理可知,氧元素原子的价电子构型是2s22p4。
(4)非金属性越强,电负性越大,氧元素的非金属性其余硫元素的,所以氧元素的电负性大于硫元素的。金属性越强,第一电离能越小,铝的金属性弱于K的,所以第一电离能是Al>K。
(5)根据价层电子对互斥理论可知,SO2中S原子的孤对电子对数是(6-2×2)÷2=1,所以SO2是含有极性键的极性分子,空间构形是V型。
本题难度:一般
4、选择题 X、Y、Z三种短周期元素在周期表中的位置如图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是

A.气态氢化物的沸点:Z<Y
B.Z元素的氧化物对应的水化物一定是一种强酸
C.三种元素原子半径的大小顺序为: X>Y>Z
D.Z单质与Fe反应生成的化合物中,铁元素显+3价
参考答案:A
本题解析:根据短周期元素在周期表中的相对位置可知,Y和X应该是第二周期元素。Y原子的最外层电子数是次外层电子数的3倍,实验Y应该是氧元素,则X是氮元素,Z是S元素。A、由于水分子间存在氢键,所以水的沸点高于H2S的沸点,A正确;B、硫酸是强酸,但亚硫酸是弱酸,B不正确;C、同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以三种元素的原子半径大小顺序是Z>X>Y,C不正确;D、硫与铁化合生成的是氯化亚铁FeS,得不到+3价铁,D不正确,答案选A。
本题难度:一般
5、选择题 有人认为处于第IA族的氢元素也可以放在其他主族中,下列有关说法不正确的是
A.根据氢元素再得一个电子形成稳定结构可以放在第ⅦA族
B.根据氢元素可与碱金属元素形成离子化合物NaH,可以放在ⅦA族
C.氢元素应放在氟元素的上边
D.根据氢元素最高正价与最低负价的绝对值相等可以放在ⅣA族
参考答案:C
本题解析:卤族元素最外层电子数为7,得到一个即为稳定结构,形成负一价阴离子,而氢元素原子最外层只有一个电子层,一个电子,得到一个电子也形成相对稳定结构,如NaH。卤族元素从上到下非金属性逐渐减弱,即氟元素非金属最强,明显,氢元素非金属性较弱,不能置于氟元素上方,C错。
本题难度:一般