微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是
[? ]
正极?
负极
电解质溶液
A.
Zn?
Cu
CuCl2
B.
Cu
Zn
H2SO4
C.
Ag?
Zn
CuSO4
D.
Fe?
Zn
CuCl2
参考答案:C
本题解析:
本题难度:简单
2、填空题 (1)事实证明,原电池中发生的反应通常是放热反应。利用下列化学反应可以设计成原电池的是 。?
A.C(s)+H2O(g) CO(g)+H2(g) ΔH>0
CO(g)+H2(g) ΔH>0
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH<0
NaCl(aq)+H2O(l) ΔH<0
C.2H2(g) +O2(g) 2H2O(l) ΔH<0
2H2O(l) ΔH<0
D.CaCO3(s)+2HCl(aq) CaCl2(aq)+H2O(l)+CO2(g) ΔH<0
CaCl2(aq)+H2O(l)+CO2(g) ΔH<0
E.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH<0
CO2(g)+2H2O(l) ΔH<0
(2)有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断A、B、C、D的活动性由强到弱的顺序是 。?
参考答案:(1)CE (2)D>A>B>C
本题解析:(1)原电池是自发进行的氧化还原反应,由条件知反应通常是放热反应,A为吸热反应,B、D不是氧化还原反应,选C、E。(2)本题考查原电池原理的应用。根据原电池原理:活动性不同的金属组成原电池时,活泼金属作负极,失电子,发生氧化反应,较不活泼的金属作正极,据此可以判断金属活动性的强弱。活泼金属作负极,被腐蚀,所以活动性A>B;A、D与等浓度盐酸反应时D比A反应剧烈,说明活动性D>A;铜与B的盐溶液不反应,但铜可置换出C,说明活动性B>C。即活动性由强到弱的顺序为D>A>B>C。
本题难度:一般
3、计算题 由铜片、锌片与200 mL硫酸组成的原电池中,若锌片只发生电化学腐蚀,则当在铜片上共放出0.15 mol气体时,H2SO4恰好全部用完。产生这些气体消耗锌多少克?所用硫酸的物质的量浓度是多少?
参考答案:9.75 g? 0.75 mol·L-1
本题解析:此反应的总反应是
Zn? +? 2H+? ="===?" Zn2+? +? H2↑
65 g? 2 mol? 1 mol
x? y? 0.15 mol
x=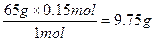 ? y=
? y=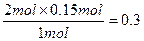 ?mol
?mol
H2SO4的物质的量为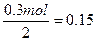 ?mol
?mol
c(H2SO4)=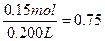 ?mol·L-1
?mol·L-1
本题难度:简单
4、填空题 (5分)某种电池的电极材料为Al和Mg,电解质溶液为KOH,
(1) 电池的负极的电极反应式为__________?
正极发生的是_______________反应(填反应类型);
(2) 总反应______________________________________________________________。
参考答案:(1) 电池的负极的电极反应式为Al-3e-+4OH-=AlO2—+2H2O(2分).
还原反应;(1分) (2) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (2分)
本题解析:略
本题难度:一般
5、填空题 在课外活动中,老师请同学们利用“Fe+Cu2+=Fe2++Cu“这个反应来设计一个原电池.甲同学设置了如图所示的装置.试回答下列问题:
(1)甲同学设计的这个原电池有什么缺点?______
(2)为了克服这个缺点,请你再设计一个原电池,画出装置图(请注明所用的电极材料和电解质溶液)装置图:______.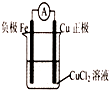
参考答案:(1)该装置理论上能构成原电池,但一般选用活泼性相差较大的两种金属,这样电势差更大,电流更明显,铜和铁的活泼性相差不很大,导致产生的电流不明显,
故答案为:电流不明显;
(2)根据电池反应式知,铁失电子,作正极,则选取不如铁活泼的且与铁活泼性相差较大的金属或导电的非金属作正极,含有铜离子的盐作电解质溶液,
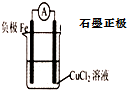
,故答案为:

.
本题解析:
本题难度:一般