微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g来源:91考试网 www.91exAm.org)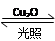 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
时间/min
| 20
| 40
| 60
| 80
|
n(O2)/mol
| 0.001 0
| 0.001 6
| 0.002 0
| 0.002 0
|
?
下列说法不正确的是? ( )。
A.前20 min内的平均反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
参考答案:C
本题解析:由题意知,v(H2O)=2v(O2)= =5.0×10-5 mol·L-1
=5.0×10-5 mol·L-1
·min-1,A正确。热化学方程式表示的含义是2 mol H2O(g)完全分解生成2 mol H2(g)和1 mol O2(g),吸收484 kJ的能量,所以生成O2 0.002 0 mol时,吸收的能量为0.002 0 mol×484 kJ·mol-1=0.968 kJ,正确。C项,由于反应物只有1种,增大c(H2O),相当于压强增大,平衡向气体体积减小的方向移动,所以水的分解率降低,错误。D项,若Cu2O颗粒小,则接触面积大,反应速率快,催化效果好,正确。
本题难度:一般
2、选择题 可逆反应:2NO2(g)?2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n?mol?O2的同时生成2n?mol?NO2
②单位时间内生成n?mol?O2的同时生成2n?mol?NO
③用NO2、NO、O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态.
A.①④⑥⑦
B.②③⑤⑦
C.①③④⑤
D.全部
参考答案:①单位时间内生成n?mol?O2的同时生成2n?mol?NO2,能说明正逆反应速率的相等关系,故①正确;
②单位时间内生成n?mol?O2的同时生成2n?molNO只能说明单方向关系,不能说明正逆反应速率的关系,故②错误;
③用NO2、NO、O2表示的反应速率的比为2:2:1的状态是反应进行到任何时刻都成立的关系,不能说明达到了平衡,故③错误;
④混合气体的颜色不变化说明二氧化氮的浓度不变化,达到平衡状态,故④正确;
⑤该反应是一个反应前后气体的质量不会改变的化学反应,混合气体的质量是守恒的,容器的体积不变,导致混合气体的密度不再变化,所以该反应不一定达到平衡状态,故⑤错误;
⑥因该反应是物质的量在增大的化学反应,物质的量与压强成正比,则混合气体的压强不随时间的变化而变化,达到平衡状态,故⑥正确;
⑦混合气体的平均相对分子质量=平均摩尔质量=混合气体的总质量混合气体的总物质的量,质量是守恒的,物质的量只有达到平衡时才不变,当混合气体的平均摩尔质量不再变化,证明达到了平衡状态,故⑦正确;
故选A.
本题解析:
本题难度:简单
3、选择题 恒温、恒压下,1molA和nmolB在一个容积可变的容器中发生如下反应:A(g)+2B(g) 2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是?
2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是?
A.物质A、B的转化率之比为1:2
B.起始时刻和达平衡后容器中混合气体密度相等
C.当V正(A)=2V逆(C)时,可断定反应达到平衡状态
D.若起始时放入3molA和3nmolB,则达平衡时生成3amolC
参考答案:D
本题解析:本题考查化学平衡中平衡标志的判断,转化率、及等效平衡问题。该反应是一个气体体积减小的反应,反应条件是在恒温恒压下,A项物质A、B的转化率之比与n和 a有关,B项起始时刻密度大于达平衡后容器中混合气体密度,C项应为当2V正(A)= V逆(C)时,可断定反应达到平衡状态D项为等效平衡。
本题难度:一般
4、选择题 恒温恒压的密闭容器中发生反应A(g)+2B(g)?3C(g),能说明反应达到平衡状态的是( )
A.容器内的压强不再变化
B.混合气体的密度不再变化
C.单位时间消耗amolA,同时消耗3amolC
D.混合气体的平均相对分子质量不再变化
参考答案:A、反应物和生成物中气体的计量数之和相等,容器中压强不变,不能证明达到了平衡状态,故A错误;
B、反应前后气体的体积和质量均不变,所以密度始终不会变化,所以混合气体的密度不再变化不能说明达到了平衡状态,故B错误;
C、单位时间消耗amolA,同时消耗3amolC,证明正逆反应速率相等,达到了平衡状态,故C正确;
D、反应前后气体的总物质的量、质量均不变,所以平均相对分子质量始终不会变化,所以平均相对分子质量不再变化不能说明达到了平衡状态,故D错误;
故选C.
本题解析:
本题难度:一般
5、填空题 溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
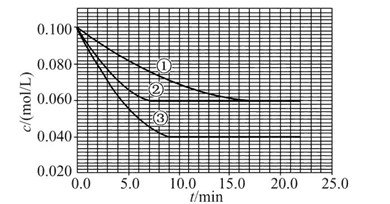
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:②?;③?。
(2)实验②平衡时B的转化率为?;实验③平衡时C的浓度为?。
(3)该反应的ΔH?0,其判断理由是?。
(4)该反应进行到4.0 min时的平均反应速率:实验②:v(B)=?。
参考答案:(1)加催化剂;达到平衡的时间缩短,平衡时A的浓度未变?温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4) 0.06 mol/L
(3)>?升高温度平衡向正反应方向移动,故该反应是吸热反应
(4)0.014 mol/(L·min)
本题解析:这是一道数形结合的反应原理试题,关键是找出图形中①②③三条曲线的转折点:达到平衡的时间①>③>②,但A的平衡浓度关系是①=②>③,说明②是使用了催化剂,③是升高温度。
(1)②使用了(正)催化剂;理由:因为从图像可看出,两者最终的平衡浓度相同,即最终的平衡状态相同,而②比①所需要的时间短,显然反应速率加快了,故由影响反应速率和影响平衡的因素可知是加入(正)催化剂;③升高温度;理由:因为该反应是在溶液中进行的反应,所以不可能是改变压强引起速率的改变,又由于各物质起始浓度相同,故不可能是改变浓度影响反应速率,再由于③和①相比,③达平衡所需时间短,平衡时浓度更小,故不可能是加催化剂,而只能是升高温度来影响反应速率的。
(2)不妨令溶液为1 L,则②中达平衡时A转化了0.04 mol,由反应计量数可知B转化了0.08 mol,所以B的转化率为 ×100%=40%;同样③中A转化了
×100%=40%;同样③中A转化了
0.06 mol,则生成C为0.06 mol,体积不变,即平衡时c(C)="0.06" mol/L。
(3)ΔH>0;理由:由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正反应方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应,ΔH>0。
(4)从图上读数,进行到4.0 min时,实验②A的浓度为:0.072 mol/L,则Δc(A)=0.100-0.072=0.028(mol/L),v(A)=Δc(A)/Δt=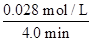 ?=
?=
0.007 mol/(L·min),所以 v(B)="2v(A)=0.014" mol/(L·min)。
本题难度:一般