微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)(1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式?
(2)工业上制取漂白粉的化学方程式为______________?______。漂白粉露置于空气中失效的原因是(用化学方程式表示):
①________?_,
②___________?________。
参考答案:(12分)
(1) Na2O2+2CO2 =2Na2CO3+O2?
(2) 2C12+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
①Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
②2HClO光2HCl+O2↑
本题解析:略
本题难度:简单
2、简答题 航天飞行器座舱内空气更新过程如下图所示:
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式为______.
(2)从装置Ⅰ、Ⅱ、Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28mol?O2,呼出23mol?CO2,则宇航员每天呼出的气体中含H2O______mol.
(3)以下是另一种将CO2转化为O2的实验设想:上述设想优点是:①吸收航天器中宇航员排出的二氧化碳气体同时产生氧气以供呼吸;②______.
(4)某同学根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧.为了确定其生成产物并进行实验论证,请你参与以下研究过程.该同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题:
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:______.
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:______.
③指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳:______.
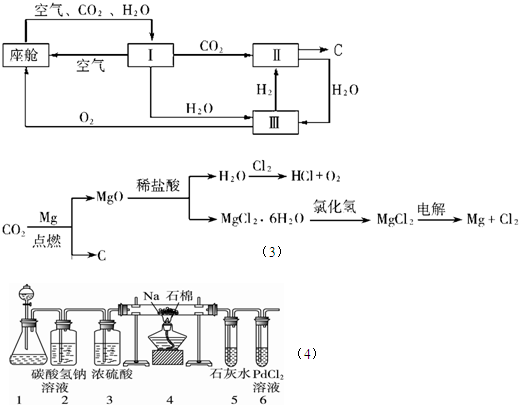
参考答案:(1)依据图示可知,反应物为二氧化碳和氢气,生成物为碳和水,故反应的化学方程式为2H2+CO2=2H2O+C,
故答案为:2H2+CO2=2H2O+C;
(2)根据氧元素守恒计算,通过图示可以看出这一更新过程中元素在整个变化中的质量并没有改变,则有呼出的氧元素的质量等于消耗氧元素的质量,消耗氧气的物质的量为28mol,即n(O)=56mol,23molCO2中含有n(O)=46mol,则需要水的物质的量为56-46=10mol,故答案为:10;
(3)②另一种将CO2转化为O2的实验设想.将Mg条在CO2中点燃生成MgO和C.加稀盐酸MgO被溶解生成MgCl2?6H2O和H2O.H2O被Cl2氧化生成HCl和O2;MgCl2?6H2O在HCl存在下转化为MgCl2,最后电解MgCl2制取Mg和Cl2.可以循环利用,
故答案为:生成的Mg和Cl2可以循环利用;
(4)①由题意可知,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置6中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应物为碳酸钠和CO,反应的化学方程式为
2Na+2CO2=Na2CO3+CO,故答案为:2Na+2CO2=Na2CO3+CO;
②装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C,反应的方程式为4Na+3CO2=2Na2CO3+C,故答案为:4Na+3CO2=2Na2CO3+C;
③根据C不溶于水分析,将4中固体加足量水,有不溶黑色固体,则生成物中有C,
故答案为:将4中固体加足量水,有不溶黑色固体,则生成物中有C.
本题解析:
本题难度:一般
3、选择题 下列关于钠的氧化物的说法正确的是(? )
A.Na2O2是白色固体,与冷水作用放出氧气,生成氢氧化钠
B.在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2
C.Na2O不稳定,能继续被氧化,生成Na2O2
D.Na2O2能与水反应,生成NaOH,所以Na2O2是碱性氧化物
参考答案:C
本题解析:Na2O2是浅黄色固体,不是白色固体,Na2O2与CO2反应时,Na2O2既是氧化剂又是还原剂,CO2在反应中元素的化合价未改变。碱性氧化物是指能与酸反应生成盐和水的氧化物,并不是指能与水反应生成碱的氧化物。另外,按Na2O2与CO2、H2O反应的规律,可推知Na2O2与酸反应时,除生成盐、水外还应有O2生成,Na2O2不是碱性氧化物。
本题难度:简单
4、选择题 向紫色石蕊试液中加入过量Na2O2粉末,振荡,正确的叙述是(?)
A.溶液仍为紫色
B.最后溶液变蓝色
C.最后溶液褪色
D.有气泡产生
参考答案:CD
本题解析:过量的Na2O2遇水反应:
2Na2O2+2H2O4 NaOH+O2↑
NaOH+O2↑
产生的现象是可以使溶液由紫色转变为蓝色(因为石蕊遇到碱),但同时有氧产生,有漂白作用,最后的结果是使蓝色褪去。故C、D两项正确。
本题难度:简单
5、选择题 科学家用NaNO3和Na2O在一定条件下化合制得由钠离子和阴离子B构成晶体NaxNO4,测定阴离子B中的各原子的最外层电子都达到了8电子稳定结构。下列说法错误的是
(?)
A.x="3"
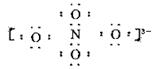
B.N的化合价为+3
C.阴离子B电子式可能为
D.此反应是非氧化还原反应
参考答案:B
本题解析:NaNO3+ (x-1)/2Na2O= NaxNO4,有O守恒则x=3;每个氮原子的价电子数为5,
每个氧原子的价电子数为6,1个NO43-离子中,含有1个氮原子和4个氧原子,并带3个
单位的负电荷,每个NO43-的电子总数为1×5+4×6+3=32,32可以写成4×8,根据题意可
知,Na3NO4中各原子最外层电子数都达到了8电子稳定结构,所以NO43-的
电子式为: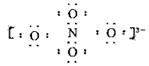 ?,氮的化合价为+5。
?,氮的化合价为+5。
本题难度:简单