微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在四个密闭容器中分别装有下表所示的一定量的物质,将它们加热至300°C,经充分反应后排出气体,则残留固体及其物质的量正确的是
A.A
B.B
C.C
D.D
参考答案:AD
本题解析:分析:A、依据碳酸氢钠加热分解生成碳酸钠、二氧化碳、水,二氧化碳和氢氧化钠反应生成碳酸钠和水分析判断;
B、依据碳酸氢钠分解生成碳酸钠、二氧化碳、水,氧化钠和二氧化碳反应,和水反应分析;
C、依据碳酸氢钠分解生成碳酸钠、二氧化碳、水,过氧化钠先和二氧化碳反应,再和水反应分析判断;
D、依据碳酸氢铵分解生成氨气、二氧化碳、水,过氧化钠和二氧化碳反应后再和水反应分析判断.
解答:A、NaHCO3加热分解:2NaHCO3=Na2CO3+CO2+H2O,1molNaHCO3分解生成碳酸钠0.5mol,二氧化碳0.5mol,水0.5mol;其中1molNaOH和0.5mol二氧化碳恰好反应生成碳酸钠,最后剩余固体为1molNa2CO3,故A正确;
B、NaHCO3加热分解:2NaHCO3=Na2CO3+CO2+H2O,1molNaHCO3分解生成碳酸钠0.5mol,二氧化碳0.5mol,水0.5mol;其中Na2O和二氧化碳,水反应:Na2O+CO2=Na2CO3,Na2O+H2O=2NaOH,剩所以,1molNa2O和 0.5molCO2,0.5molH2O恰好反应生成0.5molNa2CO3;1molNaOH,故最终固体为1molNaOH、1molNa2CO3,故B错误;
C、NaHCO3加热分解:2NaHCO3=Na2CO3+CO2+H2O,1molNaHCO3分解生成碳酸钠0.5mol,二氧化碳0.5mol,水0.5mol;其中Na2O2与二氧化碳和水反应:2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2,0.5molCO2和0.5molH2O恰好反应生成0.5molNa2CO3,1molNaOH,最终剩余固体1molNaOH、1molNa2CO3,故C错误;
D、NH4HCO3加热分解的反应为NH4HCO3=NH3↑+CO2↑+H2O,1molNH4HCO3分解生成1molNH3,1molCO2,1molH2O,其中2Na2O2+2CO2=2Na2CO3+O2,1molNa2O2和1molCO2恰好反应生成1molNa2CO3,最后剩余固体1molNa2CO3,故D正确;
故选AD.
点评:本题考查了钠及其化合物的化学性质的应用和计算,主要是碳酸氢钠分解产物和氢氧化钠、氧化钠、过氧化钠、等物质的定量反应产物的判断,关键产混合物中反应物质的化学方程式计算.
本题难度:简单
2、选择题 用20mL?0.1mol/L的含氧酸HXR04溶液与15mL?0.2mol/L的某碱M(0H)a溶液恰好完全反应,全部生成正盐,则R元素的化合价是
A.+(8-)
B.+(8-2a)
C.+(8-)
D.+(8-3a)
参考答案:C
本题解析:分析:含氧酸HXR04溶液与碱M(0H)a溶液恰好完全反应,全部生成正盐,则n(H+)=n(OH-),据此计算x的值,再利用化合价代数和为0计算R元素的化合价.
解答:20mL?0.1mol/L的含氧酸HXR04溶液中n(HXR04)=0.02L×0.1mol/L=0.002mol,则n(H+)=xn(HXR04)=0.002xmol,
15mL0.2mol/L的M(0H)a溶液中n[M(0H)a]=0.015L×0.2mol/L=0.003mol,则n(OH-)=an[M(0H)a]=0.003amol,
氧酸HXR04与碱M(0H)a恰好完全反应,全部生成正盐,则n(H+)=n(OH-),即0.002xmol=0.003amol,解得x= ,
,
令HXR04中R元素的化合价为m,根据化合价代数和为0有: +m+4×(-2)=0,解得m=+(8-
+m+4×(-2)=0,解得m=+(8- ),
),
故选C.
点评:本题考查离子反应的有关计算、化合价的有关计算等,难度不大,根据酸碱反应的本质计算x的值是解题的关键.
本题难度:困难
3、选择题 两份等质量的铝片分别与足量的盐酸和足量的氢氧化钠溶液反应,产生的气体在同条件下的体积比为
A.1∶1
B.3∶2
C.2∶3
D.1∶6
参考答案:A
本题解析:铝不论是和酸产生氢气,还是和碱反应产生氢气,都是失去3个电子的,因此生成的氢气相等,答案选A。
本题难度:一般
4、选择题 0.5 L 1 mol/L FeCl3溶液与0.2 L 1 mol/L KCl溶液中的Cl-的物质的量浓度之比为
A.5:2
B.3:1
C.15:2
D.5:2
参考答案:B
本题解析:试题分析:浓度与体积无关。两溶液中Cl-浓度比为1×3:1×1。
考点:物质的量浓度计算
点评:浓度与体积无关。
本题难度:困难
5、选择题 铵盐具有的通性是
A.都溶于水
B.都带有氨的刺激性气味
C.加热都可分解放出NH3
D.与碱混合加热都放出NH3
参考答案:AD
本题解析:铵盐都易溶于水,与强碱混合加热都放出NH3,所以A、D正确。铵盐本身没有氨的气味,加热时有的放出NH3,有的不放NH3,例如:NH4HCO3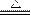 NH3↑+CO2↑+H2O,2NH4NO3
NH3↑+CO2↑+H2O,2NH4NO3![]() 2N2↑+O2↑+4H2O。
2N2↑+O2↑+4H2O。
本题难度:简单