微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
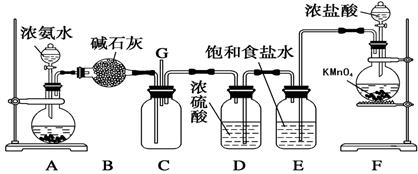
请回答下列问题:
(1)装置F中发生反应的离子方程式为_________________________。(提示,高锰酸钾的还原产物为Mn2+)
(2) B装置的名称是__________;A装置中的固体可能是________。
(3)通入C装置的两根导管左边较长、右边较短,目的是__________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:________________________
参考答案:(1)2MnO4- + 10 Cl- + 16H+ = Mn2+ + 5Cl2↑ + 8H2O?(2分)
(2) 干燥管(1分) ?碱石灰或生石灰等?(1分)
(3) 使密度大的氯气与密度小的氨气较快地均匀混合?(2分)
(4) 3Cl2+8NH3===N2+6NH4Cl ?(2分)
本题解析:(1)F装置是制取氯气的,所以根据还原产物可知,反应的方程式是2MnO4- + 10 Cl- + 16H+ = Mn2+ + 5Cl2↑ + 8H2O。
(2)根据装置B的构造可知,B是干燥管;A装置是制取氨气的,由于氨水中存在平衡NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,因此要得到氨气,则平衡必需向逆反应方向进行,所以A中的固体可以是碱石灰或生石灰。
NH4++OH-,因此要得到氨气,则平衡必需向逆反应方向进行,所以A中的固体可以是碱石灰或生石灰。
(3)由于氨气的密度小于空气的,而氯气的密度大于空气的,所以密度是使密度大的氯气与密度小的氨气较快地均匀混合。
(4)根据现象可知,白烟是氯化铵,根据原子守恒可知,另一种气体应该是氮气,所以方程式是3Cl2+8NH3===N2+6NH4Cl。
本题难度:一般
2、填空题 (16分)炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:
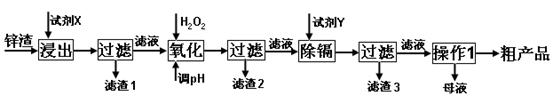
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。
试回答下列问题:
(1)“浸出”时用到的“试剂X”为?(填名称)。
(2)写出“氧化”过程的离子方程式?。
(3)“调pH”过程可以选用?。(从以下选项选择, 填序号)
A.H2SO4? B.ZnO? C.NaOH
“滤渣2”的主要成分是?(填化学式,下同)。
(4)“试剂Y”是______________;“滤渣3”的成分为______________________。
(5)“操作1”的方法是___? ____;在“操作1”时,必须采取的实验措施是?。
参考答案:(16分,每空2分)
(1)硫酸溶液?(2)2H++H2O2+2Fe2+ =2Fe3++2H2O
(3)B;Fe(OH)3? Al(OH)3?(4)Zn ;Cd和Zn?
(5)加热浓缩、蒸发结晶、过滤(洗涤);保持溶液一定的酸度
本题解析:略
本题难度:困难
3、选择题 实验室制备下列气体,通常只能用排水法收集的是
[? ]
A.NO2
B.NO
C.CO
D.Cl2
参考答案:BC
本题解析:
本题难度:简单
4、实验题 (8分) 下图是实验室制备乙酸乙酯的实验装置。试回答:
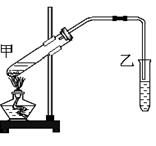
(1)试管甲中加入的试剂顺序是(?)
A.乙醇、浓硫酸、乙酸
B.浓硫酸、乙醇、乙酸
C.浓硫酸、乙酸、乙醇
(2)甲处的试管内发生反应的化学方程式为:?
(3)小试管乙中饱和Na2CO3的作用是(? )
A、吸收乙醇
B、中和乙酸
C、增大溶液密度,降低乙酸乙酯在里面的溶解度
(4)乙装置中的导管未插入溶液的目的是?。
参考答案:
(1)A
(2)CH3COOH+CH3CH2OH =CH3COOCH2CH3+H2O
=CH3COOCH2CH3+H2O
(3)ABC
(4)防止倒吸
本题解析:略
本题难度:简单
5、选择题 用下图装置进行实验,下表中实验结果能说明结论的是(?)
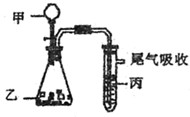
?
| 甲
| 乙
| 丙
| 结论
|
A.
水
电石
溴水
稳定性:水>C2H2>Br2
B.
盐酸
石灰石
苯酚钠溶液
酸性:HCl>H2CO3>苯酚
C.
盐酸
FeS
溴水
还原性:S2—>Br—>Cl—
D.
浓盐酸
KMnO4
KBr溶液
氧化性:Cl2> KMnO4 >Br2
|
题型:单选题难度:偏易来源:不详 答案 马上分享给同学