微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
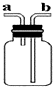
1、简答题 如图所示装置,在化学实验中十分常见,它可以作为制取气体、收集气体、性质验证、安全防护等多种作用,按要求回答相关问题:
(1)干燥CO2气体时,广口瓶中可装入的试剂1是______.
(2)除掉CO中混有的CO2,可以在广口瓶中盛装试剂2______溶液.
(3)用此装置可以用排气法收集CO2气体,应从导管口______进______出.(填a或b)
如果用此装置收集CO气体,应怎样操作,简述操作方法:______.
(4)广口瓶C中盛有BaCl2溶液,如果从b端通入CO2气体,甲同学说有沉淀生成,乙同学说没有沉淀出现.根据你所掌握的知识,判断其正确性,选择你同意的一方意见回答相关问题(两项全答计0分).
I.我同意甲同学意见,得到的沉淀物质化学式为______.
II.我同意乙同学意见,如要出现沉淀,可以预先在广口瓶中加入一些试剂3,再通入CO2气体,立即会出现沉淀,则试剂3可以是______(填试剂名称或化学式).
参考答案:(1)浓硫酸与二氧化碳不反应,浓硫酸具有吸水性,能干燥CO2气体,
故答案为:浓硫酸;
(2)若将气体通过NaOH,CO2与NaOH反应生成碳酸钠和水而被吸收,一氧化碳与氢氧化钠不反应,可除去CO中混有的少量CO2气体,从b端进,从a端出,
故答案为:NaOH;
(3)二氧化碳比空气重,用排空气法收集,应从b端进,从a端出,一氧化碳的密度比空气略小,不能用排空气法,只能用排水法,方法是将广口瓶盛满水,从a端通入气体,水从b端排出,
故答案为:b;a;将广口瓶盛满水,从a端通入气体,水从b端排出;
(4)I.如果氯化钡与二氧化碳反应,则生成碳酸钡和盐酸,因盐酸酸性比碳酸强,所以碳酸钡能溶解在盐酸中生成氯化钡和水和二氧化碳,前后矛盾,故甲同学意见错误;
II.二氧化碳和氢氧化钠反应生成碳酸钠和水,碳酸钠与氯化钡反应生成碳酸钡和水,碳酸钡难溶于水为白色沉淀,
故答案为:NaOH溶液;
本题解析:
本题难度:简单
2、实验题 实验题:I、下列方法适用于实验室中制备氨气的是____________________
A.固态氯化铵加热分解? B.向固体氢氧化钠中滴加浓氨水
C.氯化铵溶液与氢氧化钠溶液共热? D.固体氯化铵与氢氧化钙固体混合加热
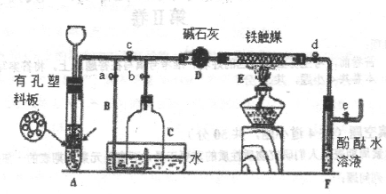
II、为了在实验室中利用工业原料制备少量氨气,有人设计了如图所示的装置(图中夹持装置均已略去)。
实验操作如下:
①检查装置的气密性后,关闭弹簧夹A.B.C.D.e。在A中加入锌粒,向长颈漏斗注入一定量的稀硫酸。打开弹簧夹C.D.e,则A中有氢气产生。在F出口处收集到氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通入氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
请回答下列问题:
(1)写出反应管E中发生反应的化学方程式_______________________________________
用方程式解释F中溶液变红的原因______________________________________________
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象为____________________________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是_____________________________________,,C中气体的主要成分为.__________________________________________.
(3)为什么用酒精灯加热反应管E-段时间后再打开弹簧夹b____________________________
(4)为什么F装置不用防倒吸的装置_________________________________________________
参考答案:
Ⅰ、bd
Ⅱ、⑴N2+3H2 2NH3;? NH3·H2O
2NH3;? NH3·H2O NH4++OH-
NH4++OH-
⑵、试管内液面下降,长颈漏斗中液因上升,直到试管内液因与锌粒分离;
使气体进入反应管E,并保证氢气含量较多,提高氮气的转化率;
氮气和氢气。
⑶、升高催化剂温度,使催化剂达到最佳活性温度,以提高反应速率。
⑷、该反应为可逆反应,且在该反应条件下,生成的氨气含量较少,在进入F装置的气体中含有较多难溶洞性的气体,所以不易产生倒吸。
本题解析:Ⅰ:a方法固态氯化铵加热分解得不到氨气,因为分解生成的氨气跟氯化氢气体在温度稍低的情况下就会结合生成氯化铵;c方法氯化铵溶液与氢氧化钠溶液共热,不能得到氨气,因为氨气在水中的溶解度大。因此选b、d
Ⅱ:①完成这一步后,相当于先在整个装置中通入了氢气,先把装置中的空气进行了排除。使氢气与氨气的反应更安全。②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,此时消耗的是无底细口瓶C中的氧气,几分钟后火焰因缺氧而熄灭;③步先点燃E处酒精灯,只是为了先给催化剂升温,因为催化剂也只有在适宜的温度下才能发挥最大的活性,对于铁触媒来说,温度应该为500℃,在这同时,继续通入氢气,待无底细口瓶C内水位下降到液面保持不变时,此时两种气体也混合的很均匀了,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,在这个地方氮气跟氢气进行反应生成氨气,但是这个反应是可逆反应,不可能大量的生成氨气,尽管氨气在水中的溶解度比较大,但由于该混合气体中氨气的量少,进入F装置的气体中,含有较多难溶性的气体,所以不易产生倒吸。
本题难度:一般
3、实验题 在实验室里用乙醇和浓硫酸反应生成乙烯,再用溴与乙烯反应生成1,2-二溴乙烷,可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。有关数据列表如下:
?
| 乙醇
| 1,2二溴乙烷
| 乙醚
|
状态
| 无色液体
| 无色液体
| 无色液体
|
密度/g·cm-3
| 0.79
| 2.2
| 0.71
|
沸点/℃
| 78.5
| 132
| 34.6
|
熔点/℃
| -130
| 9
| -116
|
(1)用下列仪器制备1,2-二溴乙烷。如果气体流向为从左到右,则正确的连接顺序是(短接口或橡皮管均已略去): 经A(1)插入A中, 接A(2),A(3)接 接 接 接 (填大写字母代号)。

(2)温度计水银球的正确位置是 。
a、支管口处? b、液面上方 c、液面以下
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a、水 b、氢氧化钠溶液 c、碘化钠溶液 d、乙醇
(6)若产物中有少量副产物乙醚,可用 的方法除去;
(7)反应过程中应用冷水冷却装置E,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
参考答案:(9分)
(1)B D C F E G
(2)c?
(3)溴的颜色完全褪去
(4)下
(5)b
(6)蒸馏
(7)避免溴大量挥发
产品1,2二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管。
本题解析:在分析过程中主要抓住两点:其一是必须除去混在乙烯中的气体杂质,尤其是SO2气体,以防止SO2与Br2发生反应SO2+Br2+2H2O 2HBr+H2SO4,影响1,2-二溴乙烷产品的制备。其二是必须在理解的基础上灵活组装题给的不太熟悉的实验仪器(如三颈烧瓶A、恒压滴液漏斗D、安全瓶防堵塞装置C),反应管E中冷水的作用是尽量减少溴的挥发,仪器组装顺序是:制取乙烯气体(用A、B、D组装)一安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G)”。
2HBr+H2SO4,影响1,2-二溴乙烷产品的制备。其二是必须在理解的基础上灵活组装题给的不太熟悉的实验仪器(如三颈烧瓶A、恒压滴液漏斗D、安全瓶防堵塞装置C),反应管E中冷水的作用是尽量减少溴的挥发,仪器组装顺序是:制取乙烯气体(用A、B、D组装)一安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G)”。
点评:本题考查的是乙烯的制备及反应的相关知识,题目难度大,注意题中信息的分析及其利用。
本题难度:一般
4、选择题 关于下列各实验装置的叙述中,不正确的是

[? ]
A.装置①可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C.装置③可用于干燥、收集NH3,并吸收多余的NH3
D.装置④可用于分离C2H5OH和H2O的混合物
参考答案:D
本题解析:
本题难度:一般
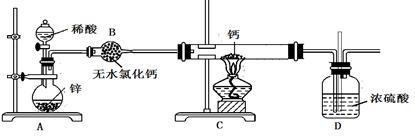
5、填空题 氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。钙在加热时能与氮气、氢气反应。氢化钙遇水立即反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。
(1)下列关于氢化钙的叙述正确的是?(选填序号)。
a.氢化钙中阴离子的半径小于Li+的半径
b.氢化钙的式量小于溴化氢,因此前者的熔点小于后者
c.氢化钙也能与盐酸反应生成氢气
d.氢气常用作还原剂,只具有还原性
(2)上图A装置中制备氢气所用的酸溶液最好选用?(选填序号)。
a.稀盐酸?b.稀硫酸?c.稀硝酸?d.均可以
(3)装置D中竖直导管的作用是?。
(4)为了确认进入装置C的氢气已经干燥,可在B、C之间再接一装置,该装置中加入的试剂是?。加热C装置前要对H2验纯,验纯的操作是?。
(5)甲同学认为只要装置合理、操作规范就可以排除生成?(选填序号)。
a.Ca3N2? b.CaO? c.Ca(OH)2
(6)乙同学用下图装置测定制得的氢化钙的纯度。他称取48g样品,与足量的水反应,恒温时,注射器量出产生的气体为48.16 L(已换算为标准状况)。假设钙只与氢气发生了反应,请根据乙同学的实验数据计算氢化钙的纯度(写出计算过程)?。

参考答案:(1)c
(2)b?
(3)平衡压强,防止后面导管堵塞
(4)无水硫酸铜(或其他合理答案);收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音
(5)a、b、c。
(6) 或0.875
或0.875
本题解析:(1)a中,氢化钙中H-和Li+的电子构型相同,Li的核电荷数大,半径小,a说法不正确;b项,氢化钙是离子晶体,溴化氢是分子晶体,因此前者的熔点大于后者,不正确;d项,氢气与Ca反应,作氧化剂,d不正确。
(2)制备H2时,使用稀盐酸,气体带HCl气体,也能与Ca反应;使用稀硝酸,气体为氮化物,不会产生H2,所以不行。
(3)洗气瓶中插入液体内部的导管与空气联通,有平衡压强,防止后面导管堵塞(竖直导管意义不大)。
(4)检验水蒸气,一般使用无水硫酸铜(若用水蒸气未除去,则变蓝色);用排水法收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音
(5)开始通入H2,可以排除装置中的空气,没有N2、O2和水蒸气,不会产生Ca3N2、CaO、Ca(OH)2等杂质。
(6)42g·mol-1 n(CaH2)+40 g·mol-1n(Ca)=48
2n(CaH2)+n(Ca)=  ?解得,n(CaH2)=1mol?
?解得,n(CaH2)=1mol?
则氢化钙的纯度: =87.5%或0.875。
=87.5%或0.875。
本题难度:困难