微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
参考答案:B
本题解析:发生的反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑,+4H2O;3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O,39.2g沉淀为Cu(OH)2设Cu的物质的量为xmol,Cu2O的物质的量为ymol,依题意可列方程式64x+144y=27.2;(x+2y)×98=39.2解得x=0.2moly=0.1molA、x:y=0.2:0.1=2:1,正确;B、由方程式可知NO的物质的量0.2mol,所以HNO3的物质的量为1.2mol,其物质的量浓度为1.2mol·L-1,错误;C、由方程式可知NO的物质的量0.2mol,其体积为4.48L,正确。D、由方程式可知反应的硝酸的总量为1mol,故剩余的硝酸的量为0.2mol,故选B。
本题难度:一般
2、选择题 在一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+ H2O=RO42-+2Cl-+2H+,从而可知在RO3n-中,元素R的化合价是
A.+4价
B.+5价
C.+6价
D.+7价
参考答案:A
本题解析:在离子RO3n-中R的化合价为+(6-n),反应后变为+6价,失去6-(6-n)=n个电子。氯气中氯元素的化合价从0价降低到-价。得到1个电子,即氯气在反应中得到2个电子,所以根据电子得失守恒可知,n=2,则RO3n-中,元素R的化合价是+(6-n)=+4价,答案选A。
本题难度:一般
3、填空题 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-?H++A2-。
(1)常温下NaHA溶液的pH________(填序号),原因是_________________。
A.大于7 ?B.小于7
C.等于7? D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)?Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度? B.降低温度
C.加入NH4Cl晶体? D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
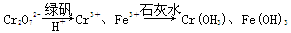
(1)该废水中加入绿矾和H+,发生反应的离子方程式为____________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
参考答案:Ⅰ.(1)B NaHA只能发生电离,不能发生水解
(2)BC
(3)BD
Ⅱ.(1)Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
(2)3.0×10-6mol·L-1
本题解析:H2A在水中的一级电离进行完全,则HA-不水解只电离,故NaHA溶液呈酸性。HA-在水中部分电离,0.1 mol·L-1的NaHA溶液中c(H+)小于0.1 mol·L-1,加入0.1 mol·L-1KOH溶液至溶液呈中性时消耗的KOH溶液体积小于NaHA溶液体积,则混合溶液中c(Na+)>c(K+);由电荷守恒知,c(Na+)+c(K+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),且c(H+)=c(OH-),则c(Na+)+c(K+)=c(HA-)+2c(A2-);水的离子积与温度有关;混合液中c(Na+)>0.05 mol·L-1;降温、增大c(A2-)都能使平衡CaA(s)?Ca2+(aq)+A2-(aq)左移。废水中加入绿矾和H+,根据流程图,可知发生的是氧化还原反应,配平即可。c(Cr3+)/c(Fe3+)=[c(Cr3+)·c3(OH-)]/[c(Fe3+)·c3(OH)-]=Ksp[Cr(OH)3]/Ksp[Fe(OH)3]=1.5×10-7,故c(Cr3+)=3.0×10-6 mol·L-1。
本题难度:困难
4、选择题 KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,有关该反应,说法不正确的是:(?)
A.被氧化的元素和被还原的元素的质量之比5:1
B.Cl2既是氧化产物,又是还原产物
C.盐酸既体现酸性,又体现酸性还原性
D.转移5mol电子时,产生67.2L的Cl2
参考答案:D
本题解析:在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,KClO3中的Cl得到电子,被还原变为Cl2,每摩尔的Cl得到5mol的电子,HCl中的Cl失去电子,也变为Cl2,每摩尔的Cl失去1mol的电子。A.由于在氧化还原反应中电子得失数目相等。因此被氧化的元素和被还原的元素的质量之比5:1。正确。B.Cl2既是氧化产物,又是还原产物。正确。C.在该反应中6mold HCl促进反应,有1mol的起酸的作用,有5mol的作还原剂。故在该反应中盐酸既体现酸性,又体现酸性还原性。正确。? D.转移5mol电子时,产生3mold的Cl2。在标准状况下其体积为67.2L。却条件,体积大小无意义。错误。
本题难度:一般
5、选择题 氮的某氧化物中,氮元素与氧元素的质量比为7:20,此氧化物中氮的化合价为(?)
A.+1
B.+2
C.+3
D.+5
参考答案:D
本题解析:氮、氧物质的量比为7/14:20/16=2:5,所以氮的氧化物化学式为N2O5,氮为+5价。
点评:原子个数比=质量比/相对原子质量比。
本题难度:一般