微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述不正确的是(? )
A.铁表面镀锌,锌作阳极
B.船底镶嵌锌块,锌作正极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH-
D.工业上电解饱和食盐水的
参考答案:B
本题解析:A、电镀时,镀层金属作阳极,铁表面镀锌,则金属锌作阳极,正确;B、船体外壳为钢板,镶嵌锌块,在海水或河水可形成原电池,锌的活动性比铁强,锌失电子发生氧化反应,作负极,不正确;C、钢铁吸氧腐蚀的负极反应为:Fe – 2e– = Fe2+,正极反应为:O2 +2H2O+4e-=4OH-,正确;D、用惰性电极电解饱和食盐水时,阳极为Cl-放电,电极反应为:2-2e-=Cl2↑,正确。
本题难度:一般
2、选择题 2008年,美籍华裔科学家钱永健获得该年度诺贝尔化学奖.他16岁时,凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项.下列说法不正确的是( )
A.船底镶嵌锌块,锌作负极,以防船体被腐蚀
B.钢铁吸氧腐蚀的正极反应:O2+4H++4e-=2H2O
C.与铜质水龙头连接处的钢质水管易发生腐蚀
D.锡青铜(铜锡合金)文物在潮湿环境中的腐蚀比干燥环境中快
参考答案:A、船底镶嵌锌块,锌作负极,易被腐蚀,金属铁正极,被保护了,船底镶嵌锌块,锌作负极可以防船体金属铁被腐蚀,故A正确;
B、钢铁吸氧腐蚀的正极反应:2H2O+O2+4e-=4OH-,在酸性环境下发生析氢腐蚀,故B错误;
C、与铜质水龙头连接处的钢质水管形成的原电池中,金属铁为负极,易被腐蚀,故C正确;
D、铜锡合金文物在潮湿环境中会生成原电池,金属锡的腐蚀速率加快,故D正确.
故选B.
本题解析:
本题难度:简单
3、选择题 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),
如图所示。导致该现象的主要原因是液滴下面的氧气
含量比液滴边缘少。下列说法正确的是

A.(a)区腐蚀比(b)区腐蚀严重
B.该过程发生了化学反应:4Fe+3O2→2Fe2O3
C.该过程是析氢腐蚀,负极反应为:Fe-2e →Fe2+
D.该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e→4OH-
参考答案:D
本题解析:中性环境下,铁发生了电化学腐蚀的吸氧腐蚀,由于液滴下面的氧气含量比液滴边缘少,故(b)区腐蚀严重;
负极:Fe-2e →Fe2+?正极:O2+2H2O+4e→4OH-
故正确的说法是D
本题难度:一般
4、选择题 如图所示:甲为稀硫酸,乙为氯化铜溶液,电极材料用元素符号表示,则下列说法中正确的是
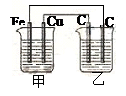
A.甲装置将电能转变为化学能
B.乙装置中左边的碳棒上有红色金属析出
C.甲中Cu为阳极
D.甲中Fe的质量少了0.56g,乙中右边的碳棒质量增加了0.64g
参考答案:D
本题解析:铁和稀硫酸反应生成氢气,则根据装置图可知,甲是原电池,乙是电解池,A不正确。甲中铁是负极,铜是正极。所以乙装置中左边的碳棒是阳极,溶液中的氯离子放电,生成氯气,B不正确;C不正确,D正确,0.56g铁是0.01mol,失去0.02mol,则根据电子的得失守恒可知,乙中右边的碳棒析出铜的物质的量是0.01mol,质量是0.64g,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。该题的关键是明确原电池和电解池的工作原理,然后结合题意和装置图灵活运用即可,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
5、选择题 下列说法正确的是
[? ]
A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀
C.钢铁电化学腐蚀的两种类型主要区别在于水膜的pH不同,引起的正极反应不同?
D.无论哪种类型的腐蚀,其实质都是金属被氧化
参考答案:CD
本题解析:
本题难度:简单