| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《离子共存》高频考点强化练习(2017年最新版)(六)
参考答案:C 本题解析:在室温下纯水电离产生的c(H+)=10-7mol/L,现在是由水电离出的c (H+)=10-13mol/L,说明在溶液中含有酸或碱,A.在碱性溶液中NH4+会发生反应而不能大量存在;若溶液为酸性则CO32-会发生反应而不能大量共存,错误;B.在酸性溶液中AlO2-不能大量存在,在碱性溶液中Mg2+不能大量存在,错误;C.Ba2+、Na+、OH-、NO3-无论是在酸性溶液还是碱性溶液中都不会发生反应,所以能够大量存在,正确;D.在酸性溶液中Fe2+和NO3-会发生氧化还原反应而不能大量存在,在碱性溶液中Fe2+会发生沉淀反应而不能大量存在,错误。 本题难度:一般 4、选择题 在无色透明的酸性溶液中,能大量共存的离子组是( ) |
参考答案:B
本题解析:A Ag+、S2-、SO42-会反应生成AgS、Ag2SO4沉淀而不能共存。错误。B 不会发生任何反应,可共存,正确。C 在酸性条件下CH3COO- 不能存在。错误。D Cu2+有颜色,错误。
考点:离子反应、离子共存等知识。
本题难度:一般
5、填空题 某溶液A只含有NH4+、Na+、Mg2+、Al3+、CO32-、SO42-中的几种,若取A溶液加入Na2O2粉末,有无色无味的气体放出,并生成白色沉淀,加入Na2O2的量为X,生成沉淀的量为Y,则有如右图所示关系,可知: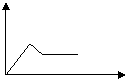 ?
?
(1)A中一定有__________离子?
(2 ) A中一定没有___________离子?
(3 ) A中可能有_____________离子?
参考答案:(1):Mg2+、Al3+?、SO42-?
(2):NH4+、CO32-
(3):Na+
本题解析:加入Na2O2粉末,放出有无色无味的气体,说明溶液中不含NH4+;有白色沉淀生成,说明一定有Mg2+、Al3+中的一种或二种;CO32-会同Mg2+、Al3+发生反应,说明一定没有CO32-;根据加入Na2O2的量与生成沉淀量的图所示关系,可知溶液A中一定有Mg2+、Al3+?。这样溶液A中现可以肯定的是:一定有Mg2+、Al3+,一定没有NH4+、CO32-。Na+和SO42-从实验现象还不能确定是否存在,但根据溶液呈电中性的原理,A溶液中一定存在SO42-。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《键参数——键能、.. | |