微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是
[? ]
A. Na2CO3 NaCl NaOH
B. NaOH NaCl Na2CO3
C. NaCl NaOH Na2CO3
D. NaCl Na2CO3 NaOH
2、选择题 下列气体中体积最大的是
A.22.4?L?H2
B.含3.01×1023个分子的Cl2
C.10g?NH3
D.无法确定
3、实验题 下图为蒸馏实验装置:
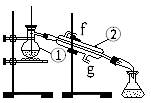 ?
?
⑴ 写出下列仪器的名称:
①??;②?。
⑵ 在仪器①中还需加入碎瓷片,其作用是:?。
⑶ 仪器②使用时水流的方向是:?进?出(用“f”、“g”填空)。
⑷ 若利用装置I分离四氯化碳和酒精的混合物,还缺少的一种仪器是?,错误的一个地方是?,
实验中承接液体的容器用锥形瓶而不用烧杯的原因是:
?。
4、填空题 若要除去下列各物质中的杂质,写出所用试剂:
(1)除去MgCl2中混有的少量MgCO3,可选用? ?溶液
?溶液
(2)除去FeCl2中混有的少量Cu2+,可选用?
(3)除去Fe粉中混有的少量Al粉,可选用 ??溶液_
5、填空题 高纯超微细草酸亚铁可用于合成新型锂电池电极材料,工业上可利用提取钛白粉的副产品绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+2NH3·H2O=Fe(OH)2↓+(NH4)2SO4
Fe(OH)2+H2C2O4=FeC2O4+2H2O
(1)绿矾中含有一定量的TiOSO4杂质。将绿矾溶于稀硫酸,加入铁粉、搅拌、充分反应并保持一段时间,过滤,可得纯净的FeSO4溶液。在上述过程中,TiOSO4能与水反应转化为H2TiO3沉淀,写出该反应的化学方程式:?;加入铁粉的作用有?、?。
(2)由纯净的FeSO4溶液制取FeC2O4时,需在真空环境下进行,原因是?。
FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致
FeC2O4的产率?(填“偏高”、“偏低”或“无影响”)。
(3)将含有FeC2O4的混合液过滤,将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是?、?。
(4)某研究小组欲从某化工残渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4。请补充完整由该化工残渣制备较纯净的FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量该化工残渣中加入足量的稀硫酸充分反应,过滤,?,过滤,得到较纯净的FeSO4溶液。