微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是
[? ]
A. Na2CO3 NaCl NaOH
B. NaOH NaCl Na2CO3
C. NaCl NaOH Na2CO3
D. NaCl Na2CO3 NaOH
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列气体中体积最大的是
A.22.4?L?H2
B.含3.01×1023个分子的Cl2
C.10g?NH3
D.无法确定
参考答案:D
本题解析:分析:根据n= 计算氯气的物质的量,根据n=
计算氯气的物质的量,根据n= 可以计算氨气的物质的量,物质的量一定时,影响气体体积的元素有温度与压强.
可以计算氨气的物质的量,物质的量一定时,影响气体体积的元素有温度与压强.
解答:含3.01×1023个分子的Cl2的为0.5mol,10g?NH3的物质的量为 =
=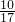 mol,由于气体所处的状态不确定,气体摩尔体积不确定,无法计算其体积,故无比较体积大小,故选D.
mol,由于气体所处的状态不确定,气体摩尔体积不确定,无法计算其体积,故无比较体积大小,故选D.
点评:本题考查常用化学计量的有关计算,难度不大,注意物质的量一定时影响气体体积的因素有压强、温度.
本题难度:一般
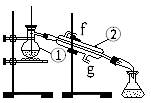
3、实验题 下图为蒸馏实验装置:
 ?
?
⑴ 写出下列仪器的名称:
①??;②?。
⑵ 在仪器①中还需加入碎瓷片,其作用是:?。
⑶ 仪器②使用时水流的方向是:?进?出(用“f”、“g”填空)。
⑷ 若利用装置I分离四氯化碳和酒精的混合物,还缺少的一种仪器是?,错误的一个地方是?,
实验中承接液体的容器用锥形瓶而不用烧杯的原因是:
?。
参考答案:(1)蒸馏烧瓶;冷凝管;(每空1分)
(2)防止暴沸(1分)
(3)g; f(每空1分)
(4)酒精灯(1分);温度计水银球不能浸入液体中(2分);分馏(2分);
本题解析:略
本题难度:简单
4、填空题 若要除去下列各物质中的杂质,写出所用试剂:
(1)除去MgCl2中混有的少量MgCO3,可选用? ?溶液
?溶液
(2)除去FeCl2中混有的少量Cu2+,可选用?
(3)除去Fe粉中混有的少量Al粉,可选用 ??溶液_
参考答案:稀盐酸?铁粉?氢氧化钠
本题解析:略
本题难度:简单
5、填空题 高纯超微细草酸亚铁可用于合成新型锂电池电极材料,工业上可利用提取钛白粉的副产品绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+2NH3·H2O=Fe(OH)2↓+(NH4)2SO4
Fe(OH)2+H2C2O4=FeC2O4+2H2O
(1)绿矾中含有一定量的TiOSO4杂质。将绿矾溶于稀硫酸,加入铁粉、搅拌、充分反应并保持一段时间,过滤,可得纯净的FeSO4溶液。在上述过程中,TiOSO4能与水反应转化为H2TiO3沉淀,写出该反应的化学方程式:?;加入铁粉的作用有?、?。
(2)由纯净的FeSO4溶液制取FeC2O4时,需在真空环境下进行,原因是?。
FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致
FeC2O4的产率?(填“偏高”、“偏低”或“无影响”)。
(3)将含有FeC2O4的混合液过滤,将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是?、?。
(4)某研究小组欲从某化工残渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4。请补充完整由该化工残渣制备较纯净的FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量该化工残渣中加入足量的稀硫酸充分反应,过滤,?,过滤,得到较纯净的FeSO4溶液。
参考答案:(1)TiOSO4+2H2O=H2TiO3↓+H2SO4(2分)
防止Fe2+被氧化、调节溶液pH、除去杂质(合理答案均可)
(2)避免生成的Fe(OH)2等物质被氧化(合理答案均可)(2分)?偏低(2分)
(3)除去固体表面的杂质、使产品快速干燥、减少产品的损耗等(2分,每答对1点给1分)
(4)向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,(3分)
本题解析:(1)溶液中的亚铁离子易被空气中的氧气氧化,所以加入铁粉防止Fe2+被氧化;铁粉与溶液中氢离子反应,促进TiO2+水解完全沉淀从而除去;(2)在制备过程中反应生成更易被氧化的Fe(OH)2,在无氧条件下是防止氧气把其氧化为Fe(OH)3;实验过程中若溶液酸性过强易生成酸式草酸亚铁,导致产率偏低。(3)乙醇具有较强挥发性,沉淀已水洗,再用乙醇洗涤显然是使产品快速干燥,防止在加热或在空气中缓慢干燥发生反应对产品的质量产生影响;(4)制备纯净的FeSO4溶液需要除去杂质,先加酸溶解过滤除去二氧化硅,再加过量碱除去铝离子,再加硫酸、铁粉等得到纯净的FeSO4溶液。
本题难度:一般