微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为____________。
(2)上述反应中的氧化剂是________?,反应产生的气体可用_________吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+?3S+10NO2↑+?2H2O 若生成2mol?H3AsO4,则反应中转移电子的物质的量为____________。若将该反应设计成一原电池,则NO2应该在_____________(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L?O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量________(选填编号)。
a.小于0.5?mol?b.等于0.5?mol?c.大于0.5mol?d.无法确定
参考答案:(1)1:1
(2)As2S3;氢氧化钠(或硫酸铜溶液)
(3)10mol;正极
(4)a
本题解析:
本题难度:一般
2、选择题 人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,
Ag2O+H2O+2e-==2Ag+2OH-。据此判断氧化银是
[? ]
A.负极,并被氧化
B.正极,并被还原
C.负极,并被还原
D.正极,并被氧化
参考答案:B
本题解析:
本题难度:简单
3、选择题 将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如下图所示。最先观察到变为红色的区域为( )
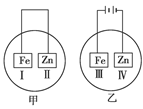
A.Ⅰ和Ⅲ
B.Ⅰ和Ⅳ
C.Ⅱ和Ⅲ
D.Ⅱ和Ⅳ
参考答案:B
本题解析:甲图示是原电池,锌做负极,锌失电子形成锌离子,正极是Ⅰ,在正极上,O2+2H2O+4e-=4OH-;所以Ⅰ处变红;乙图示是电解池,铁做阳极,铁失电子生成亚铁离子,锌做阴极,在阴极上,2H++2e-=H2↑,破坏了锌片附近水的电离平衡,使得OH-浓度增大,所以Ⅳ处也变红.故选B.
点评:本题考查了原电池和电解池的工作原理的应用,主要是电解反应的离子变化.
本题难度:简单
4、选择题 X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y:X和Z作原电池电极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电;M的离子的氧化性强于Y的离子.则这四种金属的活动性由强到弱的顺序为( )
A.X>Y>Z>M
B.X>Z>M>Y
C.M>Z>X>Y
D.X>Z>Y>M
参考答案:X可以从Y的盐溶液中置换出Y,说明X的活动性大于Y;
X和Z作原电池电极时,Z为正极,说明X的活动性大于Z;
Y和Z的离子共存于电解液中,Y离子先放电,说明Z的活动性大于Y;
M的离子的氧化性强于Y的离子,说明Y的活动性大于M,
所以得出这四种金属的活动性由强到弱的顺序为X>Z>Y>M,
故选D.
本题解析:
本题难度:简单
5、选择题 将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是
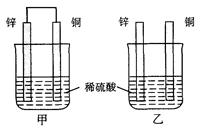
A.甲装置子中电能转化为化学能
B.乙装置中电能转化为化学能
C.甲装置中铜片表面有气泡产生
D.乙装置中铜片表面有气泡生成
参考答案:C
本题解析:略
本题难度:简单