微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知热化学方程式:SO2(g)+ O2(g) 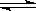 ?SO3(g)?△H =" ―98.32" kJ/mol,在容器中充入2molSO2?和1molO2充分反应,最终放出的热量为
?SO3(g)?△H =" ―98.32" kJ/mol,在容器中充入2molSO2?和1molO2充分反应,最终放出的热量为
A.196.64kJ
B.196.64kJ/mol
C.<196.64kJ
D.>196.64kJ
参考答案:C
本题解析:因为反应是可逆反应,2molSO2和1molO2充分反应不可能全部转化生成2molSO3,因此最终放出的热量要小于196.64kJ,答案是C。
本题难度:一般
2、选择题 下列事实不能用勒夏特列原理解释的是(? )
A.打开汽水瓶时,有大量气泡溢出
B.在配制硫酸亚铁溶液时往往要加入一定量铁粉
C.氨水应密闭保存放置于低温处
D.实验室用排饱和食盐水的方法收集氯气
参考答案:B
本题解析:勒夏特列原理是指:如果改变影响平衡的一个条件(如浓度、温度、压强等),平衡就会向着能够减弱这种改变的方向上移动;
A可以,打开汽水瓶,压强减小,气体的溶解度减小;B不可以,在配制硫酸亚铁溶液时要加入一定量铁粉是为了防止亚铁离子被空气中的氧气氧化;C可以,氨水易挥发,且温度越高,越易挥发;D可以,排饱和食盐水的方法收集氯气可降低氯气的溶解度;
本题难度:一般
3、填空题 (14分)T℃时,将3mol气体A和1mo1气体B通入容积为2L且固定不变的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
(1)从反应开始到平衡状态,生成C的平均速率为?;X=?;
(2)若向原平衡混合物的容器中再充入amolC,在T℃达到新的平衡,此时B的物质的量为n(B)=?;
(3)保持温度和容积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡
向右移动的是?;
A.均减半? B.均加倍? C.均增加0.4mol? D.均减少0.4mol
(4)若上述可逆反应的热化学方程式为:
3A(g)+B(g)  xC(g) ;△H =-QKJ/mol (Q>0)
xC(g) ;△H =-QKJ/mol (Q>0)
①若可逆反应达到平衡后升高体系温度,正反应速率?(填“增大”、“减小”或“不变”),平衡将?(填“左移”、“右移”或“不移动”)
②若可逆反应达到平衡后增大压强,则体系温度将?(填“升高”、“降低”或“不变”)
③若可逆反应达到平衡后,加入A,则△H?(填“变大”、“变小”或“不变”
参考答案:(1)0.2mol·L-1 ·min-1;4(2)(0.8 +0.2a)mol(3)D(4)①加快;左移②不变③不变
本题解析:(1)2min达平衡时,容器中剩余0.8molB,则消耗0.2molB,c(C)=0.4mol·L-1,则n(C)=0.8mol,v(C)=0.4mol·L-1/2min=0.2mol·L-1 ·min-1。根据反应:3A(g)+B(g)  xC(g),x=0.8mol/0.2mol=4。
xC(g),x=0.8mol/0.2mol=4。
(2)向原平衡混合物的容器中再充入amolC,在T℃达到新的平衡与原平衡等效,此时B的含量为20%。设有4xmol C转化为B,达平衡时n(B)=(0.8 + x)mol,则有: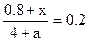 ,解得x=0.2a,故达平衡时n(B)=(0.8 +0.2a)mol。
,解得x=0.2a,故达平衡时n(B)=(0.8 +0.2a)mol。
(3)由于反应前后气体总物质的量不变,选项A、B,调整后相当于将原平衡起始量均减半或均加倍,而比例不变,达平衡时仍与原平衡等效;选项C,将均增加0.4mol分两步完成:先加入0.4molC,这与(1)相同仍为等效平衡,再加入0.4molA和0.4molB,此时使得反应体系中n(A): n(B)< 3:1,根据勒沙特列原理,化学平衡要向逆向移动;选项D,将均减小0.4mol分两步完成:先减小0.4molC,这与(1)相同仍为等效平衡,再减小0.4molA和0.4molB,此时使得反应体系中n(A): n(B)> 3:1,根据勒沙特列原理,化学平衡正向移动。?
(4)①升高温度,反应速率加快,平衡向着吸热反应方向移动(左移)。
②由于反应前后气体总物质的量不变,增加压强平衡不移动。
③由于△? H表示3molA(g)与1molB(g)完全反应释放出的热量,所以达平衡后再加入A,对△H无影响,其值也不变。
本题难度:一般
4、填空题 (12分).随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于?。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
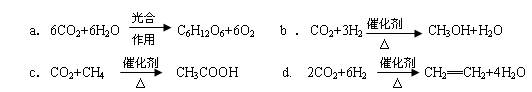
以上反应中,最节能的是?,原子利用率最高的是?。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
 ? CO2(g)+3H2(g)? CH3OH(g)+H2O(g)△H=-49.0kJ/mol
? CO2(g)+3H2(g)? CH3OH(g)+H2O(g)△H=-49.0kJ/mol
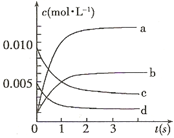
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
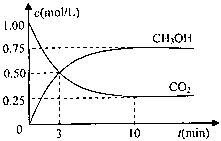
①从反应开始到平衡,氢气的平均反应速率v(H2)=?mol/(L·min)
②该反应的平衡常数表达式为?,升高温度,平衡常数的数值将
?(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是?.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1molCO2和3molH2

 ?
?