微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知298 K,101 kPa时,2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
A.Q2<Q1<197 kJ·mol-1
B.Q2=Q1=197 kJ·mol-1
C.Q1<Q2<197 kJ·mol-1
D.Q2=Q1<197 kJ·mol-1
参考答案:A
本题解析:2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1表示每有2摩尔的SO2完全反应放出热量197kJ。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,由于该反应是可逆反应,不可能完全反应所以放出热量Q1<197 kJ。向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,,可以认为是已经有一部分反应物转化为产物,所以达到平衡时放出热量为Q2< Q1。故在这三种情况下的能量关系为Q2<Q1<197 kJ/mol.选项为 A.
2SO3(g) ΔH=-197 kJ·mol-1表示每有2摩尔的SO2完全反应放出热量197kJ。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,由于该反应是可逆反应,不可能完全反应所以放出热量Q1<197 kJ。向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,,可以认为是已经有一部分反应物转化为产物,所以达到平衡时放出热量为Q2< Q1。故在这三种情况下的能量关系为Q2<Q1<197 kJ/mol.选项为 A.
本题难度:一般
2、填空题 分别为0.6mol和0.5mol的A、B两种气体,充入0.4L密闭容器中发生反应:3A(g)+B(g)? ?mC(g)+2D(g),经5min达到平衡,此时C为0.2mol。又知在此反应时间内D的平均反应速率为0.1mol·L-1·min-1,回答下列问题:
?mC(g)+2D(g),经5min达到平衡,此时C为0.2mol。又知在此反应时间内D的平均反应速率为0.1mol·L-1·min-1,回答下列问题:
(1)m值为 _____________;
(2)B的转化率为 __________;
(3)平衡时容器内物质的总物质的量为 __________;
(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是________
? ①v(A)=0.5 mol·L-1·min-1? ② v(B)=0.2 mol·L-1·min-1
?③ v(C)=0.3 mol·L-1·min-1? ④ v(D)=0.1 mol·L-1·min-1
参考答案:(1 )2?
(2 )20%?
(3)1.1mol
(4)②
本题解析:
本题难度:一般
3、选择题 在一体积固定容器内,对于N2(g)+3H2(g) 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
A.断开1个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比1∶3∶2的状态
参考答案:C
本题解析:可逆反应达到化学平衡状态的实质是正逆反应速率相等但不为0。会生成断开1个N≡N键的同时,必然会生成2分子氨气,即6个N—H键生成,A不正确。密度是气体的质量和容器体积的比值,反应前后气体质量和容器体积均不变,所以在任何时刻混合气体的密度不变,B不正确。混合气体的平均相对分子质量是混合气的质量和混合气的物质的量的比值,质量不变,但物质的量是变化的,所以C可以说明。N2、H2、NH3分子数之比1∶3∶2的状态不一定满足正逆反应速率相等,D不正确。答案选C。
本题难度:简单
4、实验题 (18分)铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
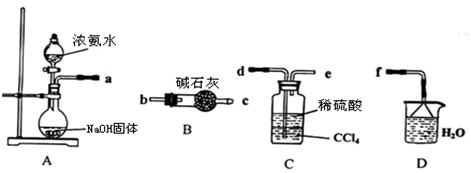
(1)仪器连接的顺序(用接口序号字母表示)是:a?
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:?
?。
(3)将装置C中两种液体分离开的操作名称是?。
(4)(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意?。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
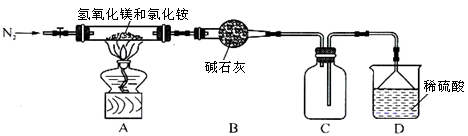 ?
?
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为?。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,
二是?。
(3)由MgCl2溶液蒸发得到MgCl2·6H2O晶体,蒸发的目的是_________。
a.得到热饱和溶液?b.析出晶体
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:?
?。
②由MgCl2·6H2O制备无水MgCl2的操作在?氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
参考答案:(18分)
Ⅰ(1)d e f? (2分)
(2)氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡NH3+H2O  ?NH4++OH—左移,有利氨气逸出。(2分)
?NH4++OH—左移,有利氨气逸出。(2分)
(3) 分液(2分)。
(4)密封、阴凉、通风(2分)
Ⅱ(1)Mg(OH)2+NH4Cl MgOHCl+NH3↑+H2O(2分)?
MgOHCl+NH3↑+H2O(2分)?
(2)防止装置C中的AlCl3溶液倒吸入装置B(2分)
(3)a(2分)
(4)①用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠。(2分)(答焰色反应也给分)
②HCl(气流)(2分)
本题解析:Ⅰ(1)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,故连接顺序为a→d→e→f。
(2)氨水中存在电离平衡: NH3+H2O  ?NH4++OH—,与NaOH混合后,NaOH电离出OH-,促使氨水电离平衡向左移动,有利氨气逸出。
?NH4++OH—,与NaOH混合后,NaOH电离出OH-,促使氨水电离平衡向左移动,有利氨气逸出。
(3)分离互不相溶的液体的方法是:分液。
(4)因为(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”,应防止水分进入,所以储存应注意密封、阴凉、通风。
Ⅱ(1)根据题目所给信息,反应物为Mg(OH)2和NH4Cl,生成物为MgOHCl、NH3和H2O,所以化学方程式为:Mg(OH)2+NH4Cl MgOHCl+NH3↑+H2O。
MgOHCl+NH3↑+H2O。
(2)防止装置C中的AlCl3溶液倒吸入装置B
(3)由MgCl2溶液得到MgCl2·6H2O晶体的方法为蒸发浓缩、降温结晶,所以蒸发的目的是:得到热饱和溶液,故a项正确。
(4)①Na元素用焰色反应进行鉴别,所以操作方法是:用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠。
②因为MgCl2为强酸弱碱盐,Mg2+发生水解反应,在HCl(气流)中可以抑制MgCl2的水解,所以由MgCl2·6H2O制备无水MgCl2的操作在HCl氛围中进行。
本题难度:一般
5、选择题 将m mol A 与n mol B 充入一密闭容器中,发生反应如下:m A(g) + n B(g)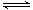 p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为
p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为
A.A1<A2
B.A1=A2
C.A1>A2
D.不能确定
参考答案:C
本题解析:
正确答案:C
因为反应放热,在绝热、恒容下温度升高,平衡逆向移动,转化率变小,C正确。
本题难度:一般