微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (共8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
?
| IA
| ?
| ?
| ?
| ?
| ?
| ?
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| ?
|
2
| ?
| ?
| ?
| ②
| ③
| ④
| ?
| ?
|
3
| ⑤
| ?
| ⑥
| ?
| ⑦
| ?
| ⑧
| ?
|
(1)、④、⑤、⑥的原子半径由大到小的顺序为 (填元素符号)。
②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(2)、①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)、由表中两种元素的原子按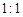 组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
a.MnO2? b.Na2SO4? c.Na2SO3? d.CaCO3
(4)、由表中元素形成的物质X、Y、Z、M、N可发生以下反应:?
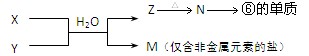
X溶液与Y溶液反应的离子方程式为 ;
常温下,为使0.1 mol/L M溶液中电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至pH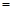 。
。
参考答案:(1).? Na>Al>O? (1分)? HClO4>H3PO4> H2CO3? (1分)
(2).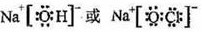 ? (1分)?(3). a? (1分)
? (1分)?(3). a? (1分)
(4).Al3++3NH3?H2O→Al(OH)3↓+3NH4+? (2分)? pH=7? (2分)
本题解析:根据元素在周期表中的位置可知,①-⑧分别是H、C、N、O、Na、Al、P、Cl。
(1).同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族自上而下,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。非金属性越强,最高价氧化物的水化物的酸性越强,所以答案是Na>Al>O 、 HClO4>H3PO4> H2CO3。
(2)符合条件的是氢氧化钠或次氯酸钠,电子式分别是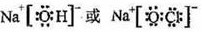
(3)该液态化合物是双氧水,常用二氧化锰作催化剂,答案选a。
(4)M是只含有非金属元素的盐,因此是铵盐。X和Y的反应应该是复分解反应,所以Z是沉淀,即为氢氧化铝,氢氧化铝加热分解得到氧化铝,氧化铝电解得到单质铝。所以X、Y分别是铝盐和氨水。M中NH4+水解显酸性,所以应该加入氨水,才有可能使M溶液中电离出的阴、阳离子浓度相等。根据电荷守恒可知,当pH=7时即可。
本题难度:一般
2、选择题 下列各图若为元素周期表的一部分(表中数字为原子序数),其中正确的是 (? )
2
| 3
| 4
| ?
| ?
| 2
| ?
| ?
| 3
| ?
| ?
| ?
| 2
| ?
| ?
|
?
| 11
| ?
| ?
| 9
| 10
| ?
| 10
| 11
| 12
| ?
| ?
| 10
| 11
| ?
|
?
| 19
| 20
| ?
| 17
| 18
| ?
| ?
| 19
| ?
| ?
| 17
| 18
| 19
| ?
|
?
| A
| ?
| ?
| ?
| B
| ?
| ?
| ?
| C
| ?
| ?
| ?
| D
| ?
|
| | | | | | | | | | | | | | | | | | | | | |
参考答案:B
本题解析:根据元素周期表的结构可知,选项B正确,其余选项都是错误的,答案选B。
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。该题的关键是熟练记住元素周期表的结构,并能灵活运用即可,有利于巩固学生的基础知识,提高学生的应试能力。
本题难度:简单
3、填空题 五种短周期元素的部分性质数据如下:
元素
| T
| X
| Y
| Z
| W
| 原子半径(nm)
| 0.037
| 0.075
| 0.099
| 0.102
| 0.143
| 最高或最低化合价
| +1
| +5
-3
| +7
-1
| +6
-2
| +3
|
(1)Z离子的结构示意图为?。
(2)关于Y、Z两种元素,下列叙述正确的是?(填序号)。
a.简单离子的半径 Y > Z
b.气态氢化物的稳定性Y比 Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10 e-分子,乙是由Y、W两种元素形成的化合物。
某同学设计了下图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是?。一段时间后,观察到试管中的现象是?,发生反应的离子方程式是?。
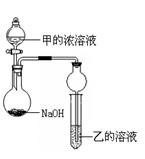
(4)XO2是导致光化学烟雾的“罪魁祸首”之一。它被氢氧化钠溶液吸收的化学方程式是:2XO2 + 2NaOH =" M" + NaXO3 + H2O(已配平),产物M中元素X的化合价为?。
参考答案:(1)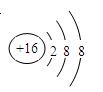
(2)b
(3)NH3+H2O NH3·H2O NH3·H2O NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小 NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小
有白色沉淀生成
Al3++3NH3·H2O =Al(OH)3↓+3NH4+
(4)+3
本题解析:略
本题难度:一般
4、选择题 已知苯(C6H6)通常是无色液体,不溶于水,密度小于1g?mL-1,沸点约为80.1℃.要从水与苯的混合物中将苯分离出来,下列方法中最为合理的是
A.蒸馏
B.分液
C.过滤
D.蒸发
参考答案:B
本题解析:分析:互不相溶的两种物质的分离用分液法.
解答:水与苯互不相溶,混合后会分层,互不相溶的两层液体分开要采用分液法,
故选B.
点评:本题考查物质的分离、提纯方法,题目难度不大,注意相关基础知识的积累.
本题难度:困难
5、选择题 NaHSO4在水溶液中能够电离出H+、Na+和SO42-。下列分类中错误的是
A.NaHSO4是盐
B.NaHSO4是酸
C.NaHSO4是钠盐
D.NaHSO4是酸式盐
参考答案:B
本题解析:硫酸氢钠是酸式盐,而不是酸,选项B不正确,其余选项都是正确的,答案选B。
考点:考查物质的有关分类。
点评:在溶液中电离出的阳离子全部是氢离子的化合物是酸,而由酸根离子和金属阳离子(或NH4+)构成的化合物是盐,据此可以进行有关判断。
本题难度:简单
|