| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《物质的组成》高频试题巩固(2017年最新版)(二)
(3)?工业上电解法处理亚硝酸盐的模拟工艺如图。 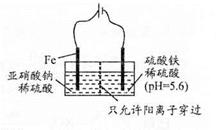 已知:阳极区发生化学反应: 2NO2-+8H++6Fe2+==N2↑ +6Fe3++4HzO ①阳极电极反应方程式是______(不考虑后续反应); ②若硫酸溶液浓度过大,阴极区会有气体逸出,该气体为______(填化学式);该现象表明c( H+ )越大,H+氧化性越______; ③若电解时电路中有0.6 mol电子转移,且NaNO2有剩余,则电解池中生成Na2SO4______mol。 参考答案:(13分)(1)CD(2分,各1分,不全对扣1分)(2) 本题解析:(1)?14N与15N质子数相同、中子数不同,互称为同位素,不是同种核素,A错误;同周期元素从左向右,第一电离能总体趋势增大,但IIA和VA反常,第一电离能:N>C,B错误;N电负性大,NH3分子间存在氢键,C正确;同系物指结构相似,分子组成相差n个CH2,D正确。 本题难度:一般 4、填空题 (8分)下列是元素周期表的短周期中的部分元素
(2)金属性最强的是?;化学性质最不活泼的是?;最高正价和负价的绝对值相等的是?;氢化物水溶液呈碱性的是?。 (3)I和L最高价氧化物对应的水化物酸性较强的是?,判断依据之一是? 参考答案:(1) Na; H ;(2) Na ,? Ne ,? C ,? NH3; 本题解析:考查元素周期表的结构及元素周期律。根据元素在周期表中的位置可知A~L分别是H、C、N、F、Ne、Na、Mg、Al、S、Cl。同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。同周期自左向右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。非金属性越强,最高价氧化物的水化物的酸性越强,氢化物的稳定性越强。比较非金属性强弱,可以利用和氢气化合的难易程度以及氢化物的稳定性,或者是单质间的相互置换能力等。 本题难度:一般 5、选择题 下列各组物质中都属于纯净物的一组是 参考答案:C 本题解析:汽水、空气、盐酸、铁矿石都属于混合物. 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《化学与健康.. | |