微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3 +I2 +H2O="2HI" + H2SO4? 2FeCl3 + 2HI=2FeCl2 + 2HCl + I2
3FeCl2 + 4HNO3=2FeCl3 + NO↑ + 2H2O +Fe(NO3)2
A.NO > Fe2+ > H2SO3 > I-
B.I- > Fe2+ > H2SO3 > NO
C.Fe2+> I- > H2SO3 > NO
D.H2SO3 > I- > Fe2+ > NO
参考答案:D
本题解析:还原剂的还原性大于还原产物的。根据方程式H2SO3 +I2 +H2O="2HI" + H2SO4? 2FeCl3 + 2HI=2FeCl2 + 2HCl + I2?3FeCl2 + 4HNO3=2FeCl3 + NO↑ + 2H2O +Fe(NO3)2,可以判断出还原性:H2SO3 > I- > Fe2+ > NO。
点评:氧化性还原性强弱的判断,高考热点问题。
本题难度:一般
2、填空题 (12分)根据下图所示的关系,确定A、B、C、D、E、F的化学式,并写有关方程式。

(1)已知A为单质,则A为 (填化学式,下同),E为 。
(2)D→E的化学方程式为___________________________________。
(3)取少量C溶于水,加入酸化的硝酸银溶液,有白 色沉淀生成,则A→C的化学方程式为_____________________________。
(4)某学习小组设计如下装置进行相关实验:

①打开活塞b,向溶液B中逐滴加入少量溴水,关闭活塞b;
②打开活塞a,向容器中滴入足量的亚硫酸。
按要求回答下列问题:
①滴入溴水时,溶液的颜色变为棕黄色,该反应的离子方程式为________。
②滴入亚硫酸时,溶液由棕黄色变为浅绿色,该反应的离子方程式为______。
③由此可知,B中的阳离子、Br-、H2SO3还原性由强到弱的顺序是___________(B中的阳离子用离子符号表示)。
参考答案:(1)Fe,Fe(OH)3 (2)4Fe(OH) 2+O2+2H2O=4Fe(OH)3 (3)2Fe+3Cl2 2FeCl3
2FeCl3
(4)①2Fe2++Br2=2Fe3++2Br- ②2Fe3++ H2SO3= 2Fe2++SO42-+2H+ ③H2SO3>Fe2+>Br-
本题解析:E是红褐色固体,则E是氢氧化铁,氢氧化亚铁和氧气反应生成氢氧化铁,所以D是氢氧化亚铁,B与碱能反应生成氢氧化亚铁,则B是亚铁盐,C是铁盐,,A为单质,则A是铁。
(1)A为Fe,E为Fe(OH)3。
(2)氢氧化亚铁生成氢氧化铁的化学方程式为4Fe(OH) 2+O2+2H2O=4Fe(OH)3。
(3)取少量铁盐溶于水,加入酸化的硝酸银溶液,有白色沉淀生成,说明该物质为氯化铁,则铁生成氯化铁的化学方程式为2Fe+3Cl2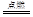 2FeCl3;
2FeCl3;
(4)溶液B是亚铁盐,①滴入溴水时,溶液的颜色变为棕黄色,铁离子棕黄色,说明溴水与亚铁离子反应,离子方程式为2Fe2++Br2=2Fe3++2Br-。②滴入亚硫酸时,溶液由棕黄色变为浅绿色,说明亚硫酸能将Fe3+还原成Fe2+,该反应的离子方程式为2Fe3++ H2SO3= 2Fe2++SO42-+2H+。③根据还原剂的还原性大于还原产物的还原性,由此可知,Fe2+、Br-、H2SO3还原性由强到弱的顺序是H2SO3>Fe2+>Br-.
考点:考查铁及其化合物的化学性质,氧化还原反应等知识。
本题难度:困难
3、选择题 利用下图装置进行实验(必要时可加热),不能得出相应结论的是
| 溶液①
| 固体②
| 溶液③
| 实验结论
| 
|
A
| 稀硫酸
| Na2CO3
| Na2SiO3
| 非金属性:C>Si
|
B
| 浓盐酸
| MnO2
| Na2S
| 氧化性:Cl2>S
|
C
| 盐酸
| CaCO3
| C6H5ONa
| 酸性:碳酸>苯酚
|
D
| 稀硫酸
| Na2CO3
| CaCl2
| CO2不与氯化钙反应
|
参考答案:C
本题解析:A、由实验可知,碳酸酸性强于硅酸,所以非金属性碳强于硅,A正确;B、由实验可知氯气与硫化钠反应生成硫单质,可知氯气氧化性强于硫,B正确;C、盐酸具有挥发性,苯酚钠生成沉淀可能是碳酸作用也可能是盐酸作用,不能说明碳酸酸性强于苯酚,C错误;D、二氧化碳通于氯化钙溶液中不产生沉淀,二氧碳不与氯化钙反应,D正确;答案选C。
考点:化学实验基础
本题难度:一般
4、选择题 向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色.再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色.则下列分析中正确的是( )
A.白色沉淀是CuI2,棕色溶液含有I2
B.滴加KI溶液时,转移1mole-时生成1mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
参考答案:CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,向反应后的混合物中不断通入SO2气体,反应方程式:SO2+2H2O+I2=H2SO4+2HI.
A、由上述分析及化学方程可知,白色沉淀是CuI,溶液中含有I2,故A错误;
B、CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,由方程式可知每转移2mol电子生成
2molCuI,所以转移1mole-时生成1molCuI白色沉淀,故B正确;
C、反应后的混合物中不断通入SO2气体,反应方程式:SO2+2H2O+I2=H2SO4+2HI,由反应可知,碘元素化合价由0价降低为-1价,被还原,所以I2是氧化剂,故C错误;
D、2CuSO4+4KI═2K2SO4+2CuI↓+I2反应中Cu2+化合价降低是氧化剂,I2是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,所以物质的氧化性:Cu2+>I2,SO2+2H2O+I2=H2SO4+2HI中碘元素化合价由0价降低为-1价,I2是氧化剂,SO2被氧化,所以物质氧化性I2>SO2,所以氧化性Cu2+>I2>SO2,故D正确.
故选:BD.
本题解析:
本题难度:简单
5、选择题 在一种酸性溶液中存在NO3-、I-、CI-、Fe3+中一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中(?)
①一定含有I-,不能确定是否有CI-?②一定含有NO3-
③不含有Fe3+?④一定含有I-、NO3-和CI-
A.①
B.②③
C.④
D.①③
参考答案:D
本题解析:略
本题难度:简单