微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可以继续进行,直至反应完全生成新物质硫化亚铁.该现象说明了
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下可以发生反应
D.生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量
参考答案:B
本题解析:加热能够达到反应所需要的条件.反应后停止加热,由于反应自身释放出的能量能够维持该反应所需要的温度条件,所以反应能够进行.从现象上看,该反应是放热反应.
本题难度:简单
2、填空题 已知反应:2H2+O2 = 2H2O+能量,请填写下列表格中空白处的总能量值,并注明消耗还是放出。有关键能:H-H:436 kJ/mol ?O-O:496 kJ/mol? H-O:463 kJ/mol
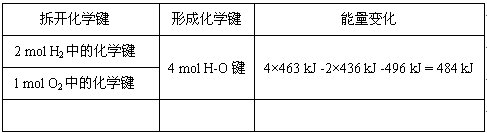
参考答案:共消耗1368kJ;共释放1852kJ;放热484KJ
本题解析:
本题难度:一般
3、填空题 (6分) 某同学进行如下实验,探究化学反应中的能量变化。
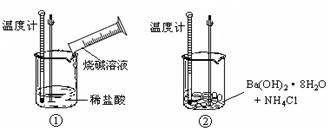
通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低。由此判断NaOH溶液跟盐酸的反应是 (填 “吸热”或“放热”)反应,Ba(OH)2· 8H2O跟NH4Cl的反应是 (填“吸热”或“放热”)反应。反应①中反应物的总能量 填(“大于”、“小于”或“等于”)生成物的总能量。反应②中断开反应物中的化学键所吸收的能量 填(“大于”、“小于”或“等于”)形成生成物中的化学键所放出的能量。
参考答案:放热、吸热、大于、大于
本题解析:略
本题难度:一般
4、选择题 下列变化中,一定需要加入还原剂才可以实现的是
A.Ag→Ag+
B.CO2→H2CO3
C.Cl2→NaCl
D.FeCl3→FeCl2
参考答案:D
本题解析:分析:在氧化还原反应中,一定需要加入还原剂才可以实现,说明所给物质为氧化剂,在反应中得电子化合价降低,据此分析解答.
解答:A.该反应中,银元素失电子化合价升高,则需要加入氧化剂才能实现,故A错误;
B.该反应中,元素的化合价没有变化,不用发生氧化还原反应,与水反应即可实现,故B错误;
C.氯气和氢氧化钠反应生成氯化钠,氯气和氢氧化钠的反应中氯气既是氧化剂又是还原剂,所以要实现Cl2→NaCl不一定需要加入还原剂,故C错误;
D.FeCl3→FeCl2中Fe元素的化合价降低,发生还原反应,则需要加入还原剂才能实现转化,如加入Fe,故D正确;
故选D.
点评:本题考查氧化还原反应,明确元素的化合价降低发生还原反应,需要加入还原剂时解答本题的关键,并应熟悉物质或离子中元素的化合价来解答.
本题难度:一般
5、填空题 依据事实,写出下列反应的热化学方程式
① 2molH2与2molI2蒸汽完全反应时,生成碘化氢气体,放出了29.8KJ的热量
______________________________________________________________
② 1克甲烷完全燃烧生成二氧化碳和液态水放出了aKJ的热,写出甲烷燃烧热的热化学方程式:
_____________________________________________________________
③ 12g镁在氧气中完全燃烧,生成氧化镁固体,放出247KJ的热量
参考答案:①H2(g) + I2(g) = 2HI(g) ΔH= -14.9kJ/mol ②CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH=
-16a kJ/mol ③Mg(s) + 1/2O2(g) ="=" MgO(s) ΔH=" -494" kJ/mol
本题解析:
试题解析:①由题意知,1molH2与2molI2蒸汽完全反应时,生成碘化氢气体,放出14.9KJ的热量,故热化学方程式为:H2(g) + I2(g) = 2HI(g) ΔH= -14.9kJ/mol;②1g甲烷燃烧生成CO2和液态水时放热akJ,1mol甲烷的质量为16g,故16g甲烷燃烧生成CO2和液态水时放热16akJ,热化学方程式为:CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH="-16a" kJ/mol;③12g镁的物质的量为0.5mol,故1mol镁在氧气中完全燃烧,生成氧化镁固体,放热为494KJ,热化学方程式为:Mg(s)+1/2O2(g)="=MgO(s)" ΔH="-494" kJ/mol。
考点: 热化学方程式书写
本题难度:一般