|
高考化学知识点归纳《物质的分离、提纯》考点预测(2017年强化版)(十)
2017-07-10 18:05:41
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
 已知:①Fe3+、Al3+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2和12.4;Al(OH)3完全溶解的pH为11.8。②常温下,饱和氨水的pH约为11。 已知:①Fe3+、Al3+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2和12.4;Al(OH)3完全溶解的pH为11.8。②常温下,饱和氨水的pH约为11。
请回答:(1)写出A与氢氧化钠溶液反应的化学方程式:?。
(2)上述流程中试剂②应该是??(填以下字母编号)。
A.氢氧化钠
B.氧化铝
C.氨水
D.水
| (3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是
?。
(4)计算溶液F中c(Mg2+)=??( 25℃时,氢氧化镁的Ksp=5.6×10-12)。
(5)工业生产中将固体C灼烧后的产物与KNO3、KOH固体加热共熔制备净水剂K2FeO4,同时获得一种亚硝酸盐,请写出制得K2FeO4的化学方程式:?。
参考答案:(共10分,每空2分)
(1)SiO2+2NaOH=Na2SiO3+H2O?(反应物、产物写错0分;没配平,扣1分)
(2)A(多选0分)
(3)镁离子沉淀不完全及氢氧化铝溶解不完全(1个点1分)
(4)5.6× 10–10 mol/L(单位1分)
(5)Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O(物质写错0分;没配平、没条件扣1分) 2K2FeO4+3KNO2+2H2O(物质写错0分;没配平、没条件扣1分)
本题解析:(1)混合物中和盐酸不反应的是二氧化硅,即固体A是二氧化硅。二氧化硅是酸性氧化物,则二氧化硅和氢氧化钠溶液反应的化学方程式是SiO2+2NaOH=Na2SiO3+H2O。
(2)溶液B中含有铁离子、铝离子和镁离子,所以根据氢氧化物沉淀时的pH可知,如果控制pH=3.7,析出的沉淀是氢氧化铁,即固体C是氢氧化铁。溶液B中含有铝离子和镁离子,则氢氧化物沉淀时的pH和氢氧化铝溶解时的pH可知,E时氢氧化镁,F是偏铝酸盐,所以试剂②是氢氧化钠,答案选A。
(3)如果pH过小,则会导致镁离子沉淀不完全及氢氧化铝溶解不完全,所以应该可知pH=13。
(4)由于溶液中OH-的浓度是0.1mol/L,所以根据氢氧化镁的溶度积常数可知,溶液中镁离子的浓度是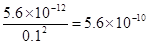 。 。
(5)氢氧化铁分解生成氧化铁,所以根据原子守恒可知,制备高铁酸钾的化学方程式是Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。 2K2FeO4+3KNO2+2H2O。
点评:该题是高考中的常见题型,试题难度较大,对学生的要求高。本题关键是明确反应的原理,理解所给的信息,然后灵活运用即可。该题有利于学生的逻辑思维能力和灵活应变能力,有利于提高学生分析问题、解决问题的能力。该题综合性强,学生不易得分。
本题难度:一般
2、选择题 现有①NaOH②Al2(SO4)3③Ba(NO3)2 ④CuSO4 ⑤FeCl3⑥淀粉溶液⑦KI 这7种溶液
A.不需外加试剂即可鉴别
B.必须外加试剂才能鉴别
C.如有碘水即能全部鉴别
D.另有一种溶液即可鉴别
参考答案:A
本题解析:CuSO4 溶液为蓝色;FeCl3溶液为棕黄色;以FeCl3溶液为试剂,加入后若有红褐色溶液生成的为NaOH;再以NaOH溶液为试剂,若加入后先有沉淀后沉淀消失的为Al2(SO4)3;再以Al2(SO4)3为试剂,加入后有白色沉淀生成的为Ba(NO3)2 ;将FeCl3溶液加入,若溶液呈黄褐色的为KI溶液,最后为学分溶液;
所以正确选项为A;
本题难度:简单
3、实验题 某课外活动小组根据Mg与CO2的反应原理,探究Mg与NO2的反应及固体产物。该小组通过实验确认Mg能在NO2中燃烧,并对固体产物提出三种假设:
I.假设为:固体产物为MgO? II.假设为:______________III.假设为:______________
请回答下列问题:资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O
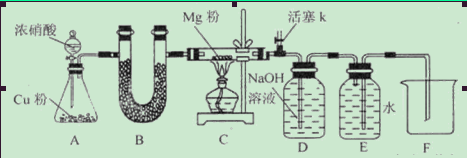
(1)如图连接好仪器,装药品前如何检验装置的气密性_____________________________
(2)装置B中盛装的干燥剂可以是(填序号)___________________
①浓硫酸?②无水CaCl2?③碱石灰?④五氧化二磷
(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的是_________________________
(4)E中收集到的气体对氢气的相对密度是14,该气体是__________________
(5)实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,则假设__________________成立。C中发生的化学反应方程式有_______________________________________________
(6)本实验中存在明显缺陷,改进措施是_______________________________________。
参考答案:Ⅱ.固体产物为Mg3N2?Ⅲ.固体产物为MgO和Mg3N2?(1)关闭分液漏斗活塞和活塞K,将导气管末端插入水中,对锥形瓶(或C处反应管)微热,若导气管口有气泡,停止加热,导气管中进入一段水柱,表示气密性良好。 (2)②④ (3)排净装置中空气,防止空气干扰实验。
(4)N2 (5)假设Ⅲ? 4Mg+2NO2 4MgO+N2? 3Mg+N2 4MgO+N2? 3Mg+N2 Mg3N2 Mg3N2
(6)活塞K处的导气管插入NaOH溶液中,进行尾气吸收。
本题解析:在NO2中含有N、O元素,所以Mg在其中燃烧产物可能是MgO、Mg3N2或它们的混合物。假设Ⅱ.固体产物为Mg3N2?。Ⅲ.固体产物为MgO和Mg3N2(1)如图连接好仪器,装药品前装置的气密性检验方法是:关闭分液漏斗活塞和活塞K,将导气管末端插入水中,对锥形瓶(或C处反应管)微热,若导气管口有气泡,停止加热,导气管中进入一段水柱,表示气密性良好。(2)Cu与浓硝酸反应产生的气体NO2是酸性气体,不能使用碱性干燥剂来干燥。排除?③碱石灰;U形管装的是固体干燥剂,而浓硫酸是液体,不能使用,排除①浓硫酸。故装置B中盛装的干燥剂可以是②无水CaCl2 ④五氧化二磷。(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的是排净装置中空气,防止空气干扰实验。(4)E中收集到的气体对氢气的相对密度是14,相对分子质量为14×2=28,该气体是N2.(5)若完全转化为MgO,则反应后的固体质量是反应前的(24+16):24=1.67倍.若完全转化为Mg3N2,则反应后的固体质量是反应前的(24×3+14×2):(24×3)=1.39倍。实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,所以得到的是MgO和Mg3N2的混合物。故假设设Ⅲ成立。C中发生的化学反应方程式有4Mg+2NO2 4MgO+N2? 3Mg+N2 4MgO+N2? 3Mg+N2 Mg3N2。(6)本实验中存在明显缺陷,就是没有尾气处理装置。改进措施是活塞K处的导气管插入NaOH溶液中,进行尾气吸收。2的反应及固体产物的成分。 Mg3N2。(6)本实验中存在明显缺陷,就是没有尾气处理装置。改进措施是活塞K处的导气管插入NaOH溶液中,进行尾气吸收。2的反应及固体产物的成分。
本题难度:困难
4、选择题 下列除杂质选用的试剂和主要操作都正确的是
?
| 物质
| 杂质
| 试剂
| 主要操作
| A
| CO2
| HCl
| Na2CO3溶液
| 洗气
| B
| NaHCO3溶液
| Na2CO3溶液
| CaCl2溶液
| 过滤
| C
| Cl2
| HCl
| 饱和NaCl溶液
| 洗气
| D
| NaCl溶液
| Na2SO4溶液
| 过量BaCl2溶液
| 过滤
参考答案:C
本题解析:A不正确,应该用饱和碳酸氢钠溶液;B不正确,应该是通入CO2气体;D不正确,应该是适量的氯化钡溶液,答案选C。
点评:把物质中混有的杂质除去而获得纯净物叫提纯,将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般
5、填空题 选用适当的试剂和除杂方法除去下列各物质中的杂质(括号中为杂质),将所选试剂和操作的名称填写在表格中。
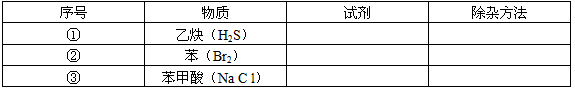
参考答案:①CuSO4溶液(或NaOH溶液);洗气;
②NaOH溶液;分液;
③水;重结晶
本题解析:
本题难度:一般
|
|