微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是______.
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式______.
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为______.
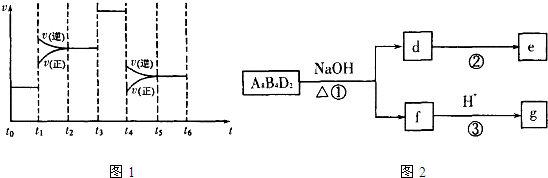
(4)化学反应3A2(g)+C2(g)?2CA3(g).当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图1表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是______.温度为T℃时,将4a mol A2和2a?mol C2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数______
(5)化合物A8B4D2有如图2转化关系.其中,g是常用调味品的主要成分.写出反应①的化学方程式______
设计实验方案完成d→e的转化______
参考答案:A、B、C、D、E五种短周期元素,原子序数依次增大.A元素的原子半径最小,则A为氢元素;B元素原子的最外层电子数是内层电子数的2倍,则B有2个电子层,最外层电子数为4,则B为碳元素;C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,则C为氮元素、X为硝酸、Y为硝酸铵;A、E同主族,E的原子序数大于碳元素,则E为Na元素;A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,则D为O氧元素,
(1)常温下,硝酸溶液中水电离中氢离子浓度等于溶液中氢氧根离子浓度为10-1410-5mol/L=10-9mol/L.硝酸铵溶液中氢离子为水电离产生的,氢离子浓度为10-5mol/L,故两溶液中由水电离出的H+浓度之比为10-9mol/L:10-5mol/L=10-4:1,
故答案为:10-4:1;
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解,该化合物为NaHCO3,少量NaHCO3溶液与足量的Ba(OH)2溶液反应生成碳酸钡、碳酸钠与是,反应的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O,
故答案为:Ba2++HCO3-+OH-═BaCO3↓+H2O;
(3)将铝片和镁片用导线相连,插入NaOH的稀溶液中构成原电池,铝与氢氧化钠溶液反应,Mg不与氢氧化钠溶液反应,故Al为负极,电极反应式为Al+4OH-═AlO2-+2H2O+3e-,
故答案为:Al+4OH-═AlO2-+2H2O+3e-;
(4)t0~t1,正逆反应速率相等,处于平衡状态;t1~t2,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆反应方向移动,导致CA3的含量降低;t2~t3,正逆反应速率相等,处于平衡状态,CA3的含量不变;t3~t4,正逆反应速率都同等程度的增大平衡不移动,CA3的含量不变;t4~t5,正逆反应速率都降低,但逆反应速率大于正反应速率,导致平衡向逆反应方向移动,CA3的含量降低;t5~t6,正逆反应速率相等,平衡不移动,CA3的含量不变,所以平衡混合物中CA3的含量最高的一段时间是t0~t1.
? 3A2(g)+C2(g)?2CA3(g)
开始(mol/L):4a? 2a? 0
变化(mol/L):3a? ? a? 2a
平衡(mol/L):a? a? 2a
故该温度平衡常数k=(2a)2a3×a=4a2
故答案为:t0~t1;4a2;
(5)化合物H8C4O2在碱性条件下得到f,f酸化得到g,g是常用调味品的主要成分,化合物为CH3COOC2H5,f为乙酸钠,反应①的化学方程式为CH3COOC2H5+NaOH△
本题解析:
本题难度:一般
2、选择题 下列化合物中只含有离子键的是
A.NaOH
B.H2O
C.MgO
D.H2SO4
参考答案:C
本题解析:A错,NaOH既含有离子键又含有极性键;B错,只含有极性键;C正确;D错,只含有极性键;
本题难度:简单
3、填空题 12分)
氟、氯、溴3种元素同属于周期表中第VIIA族。
(1)3种元素中电负性最小的基态原子的价电子排布式是?。
(2)氢氟酸是弱酸的原因是?。
(3)氯元素可广泛存在于无机物和有机物中。二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是____,氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是??分子。(“极性”或“非极性”)
(4)冰晶石(Na3AlF6)主要用作电解Al2O3生产铝的助熔剂,其晶体不导电,但熔融时能导电。在冰晶石(Na3AlF6)晶体中存在?(填选项)。
A.离子键
B.极性键
C.配位键
D.范德华力