微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 A,B,C,D是同一周期的4种元素,A,B,C,D的原子序数依次相差为1。A元素单质的化学性质活泼,A元素的原子在此周期中原子半径最大。B元素的氧化物2.0g恰好跟100 mL 0. 50 mol/L的硫酸完全反应,B元素单质跟D元素单质反应生成化合物BD2。根据以上事实填写下列空白:
(1)A的原子结构示意图为______,C的原子结构示意图为_______,BD2的电子式为_______;
(2)若向C的氧化物的水化物中加入A的氧化物的水化物,则溶液显碱性。此反应的化学方程式为
_______。
参考答案:(1)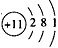 ;
;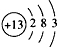 ;
;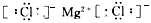
(2)Al(OH)3+NaOH==NaAlO2+2H2O
本题解析:
本题难度:一般
2、选择题 X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期,X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y少1,下列说法正确的是( )
A.元素非金属性由弱到强的顺序为Z<X<Y
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列叙述正确的是()
A.P4和NO2都是共价化合物
B.次氯酸的结构式为H-Cl-O
C.在CaO和SiO2晶体中,都不存在单个小分子
D.CCl4和NH4Cl都是以共价键结合的分子
参考答案:C
本题解析: P4是单质,A不正确;次氯酸的结构式为H-O-Cl,B不正确;CaO和SiO2晶体分别是离子晶体和原子晶体,不存在单个小分子,C正确;NH4Cl是以离子键结合的离子化合物,但含有共价键,D不正确,答案选C。
点评:本题容易错选B,这是受次氯酸的分子式HClO影响而导致的。
本题难度:一般
4、选择题 下列变化中既有离子键断裂,又有共价键断裂的是
[? ]
A.NaCl溶于水
B.HCl溶于水
C.干冰气化
D.KClO3受热分解
参考答案:D
本题解析:
本题难度:简单
5、填空题 (1)在下列物质①NH3、②BF3、③HCl、④SO3,属于非极性分子的是(填番号)________________。
(2)试比较含氧酸的酸性强弱(填“>”、“<”或“=”): HClO3________HClO4。
(3)根据价层电子对互斥理论判断:H2O的VSEPR构型为?。
(4)沸点比较:邻羟基苯甲醛 ??对羟基苯甲醛(填“>”、“<”或“=”),原因是__________
参考答案:(1)②④(1分)?
(2)<?(1分)
(3)四面体形(1分)
(4)<(1分)
本题解析:(1)对于ABn型分子,A原子的最外层电子,若完全成键,属于非极性分子,若不完全成键,则属于极性分子。故非极性分子为②④。
(2)同种元素的元素的化合价越高,对应的含氧酸的酸性越强。
(3)H2O中心原子O原子成2个σ键、含有2对孤对电子,故杂化轨道数为4,VSEPR构型为四面体形。
(4)对羟基苯甲醛的沸点高于邻羟基苯甲醛,因为对羟基苯甲醛形成分子间氢键使沸点升高,而邻羟基苯甲醛形成的是分子内氢键 。
本题难度:一般