微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在恒温恒压的密闭容器中,充入?4L?X和3L?Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)?2Q(g)+nR(g)达到平衡时测得?X的转化率为25%,此时混合气体的体积为6.5L.则该反应方程式中的n值是( )
A.8
B.6
C.5
D.3
参考答案:在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)?2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L.依据平衡的三段式计算列式计算得到:
? ? ? 4X(g)+3Y(g)?2Q(g)+nR(g)
起始量(L)? 4? 3? 0?0?
变化量(L)?4×25%=1? 34? 12?14n
平衡量(L)? 3? ? 94? 12? ? 14n
则得到:3+94+12+n4=6.5
n=3
故选D.
本题解析:
本题难度:简单
2、选择题 在373K?时,把0.5mol?N2O4气体通入体积为5L的真空密闭容器中,立即出现红棕色.N2O4?2NO2,反应进行到2s时,NO2的浓度为0.02mol/L.在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍.下列说法正确的是( )
A.前2?s,以N2O4浓度变化表示的平均反应速率为0.01?mol?L-1?s-1
B.平衡时,若往容器内充入二氧化氮气体,则可提高N2O4的转化率
C.平衡时,体系内含N2O4?0.25?mol
D.在2?s时,体系内压强为反应前的1.1倍
参考答案:A.2秒时,NO2的浓度为0.02摩/升,则转化的N2O4的浓度为0.01mol/L,则前2秒,以N2O4的浓度变化表示的平均反应速度为0.01mol/L2s=0.005mol/L.s,故A错误;
B.平衡时,若往容器内充入二氧化氮气体,相当于在原来的基础上缩小体积,由N2O4═2NO2,则缩小体积,压强增大,化学平衡逆向移动,N2O4的转化率降低,故B错误;
C.设转化的N2O4的物质的量为x,则平衡时N2O4的物质的量为0.5mol-x,NO2的物质的量为2x,由平衡时容器内压强为开始时的1.6倍,则0.5mol-x+2x0.5mol=1.6,解得x=0.3mol,则平衡时N2O4的物质的量为0.5mol-x=0.5mol-0.3mol=0.2mol,故C错误;
D.由N2O4═2NO2,2秒时NO2的物质的量为0.1mol,N2O4的物质的量为0.5mol-0.01mol/L×5L=0.45mol,由反应前后的物质的量之比等于压强之比,则在2秒时体系内的压强为开始时的0.1mol+0.45mol0.5mol=1.1倍,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 向一体积为2L的恒容密闭容器里充入1 mol N2和4 molH2,在一定温度下发生反应:
N2(g)+3H2(g) 2NH3(g);△H<0。10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
2NH3(g);△H<0。10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
A.该反应达平衡时H2的转化率为40%
B.降低温度能使混合气体的密度增大
C.向该容器中充入N2,平衡正向夥动
D.研发高效催化剂可大大提高N2的转化率
参考答案:C
本题解析:略
本题难度:一般
4、简答题 (1)某温度下,在一密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如下图所示.分析有关数据,写出X、Y、Z反应的化学方程式______.
(2)下列情况可以证明(1)中的反应已达到平衡状态的是______(填序号).
A.物质的浓度:c(X)=c(Y)=c(Z)
B.温度和体积一定时,某一生成物浓度不再变化
C.温度和体积一定时,容器内的压强不再变化
D.温度和体积一定时,混合气体的平均相对分子质量不再变化
(3)某温度下,在另一密闭容器中充入2molX和3molY,然后按(1)中化学方程式进行反应,当达到平衡时,测得Z的物质的量分数为25%,则平衡时X的转化率为______.
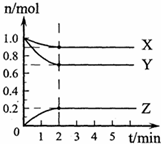
参考答案:(1)由图象可知,X、Y、Z同在2min内物质的量的变化量之比为(1-0.9):(1-0.7):(0.2-0)=1:3:2,
其比值等于化学反应速率之比,也等于化学计量数之比,且由图象可知,2min达到平衡,则该反应为X+3Y?2Z,故答案为:X+3Y?2Z;
(2)化学平衡的特征为“定”、“等”,则
A.物质的浓度:c(X)=c(Y)=c(Z),取决于起始浓度及转化率,不能说明反应达到平衡,故A不选;
B.温度和体积一定时,某一生成物浓度不再变化,为平衡的“定”特征,则反应达到化学平衡,故B选;
C.温度和体积一定时,容器内的压强不再变化,为平衡的“定”特征,则反应达到化学平衡,故C选;
D.温度和体积一定时,混合气体的平均相对分子质量不再变化,为平衡的“定”特征,则反应达到化学平衡,故D选;
故答案为:BCD;
(3)由(1)可知,反应为X+3Y?2Z,
开始 2 3
转化 x 3x 2x
平衡2-x 3-3x 2x
平衡时,测得Z的物质的量分数为25%,则2x2-x+3-3x+2x×100%=25%,
解得x=0.5mol,则X的转化率为0.5mol2mol×100%=25%,故答案为:25%.
本题解析:
本题难度:一般
5、填空题 (21分)(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键?个?,π 键?个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g)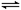 CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 ? 移动,反应混合物的颜色 。若通人N2气体,平衡 ? 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
物质
| 炭粉(C)
| 一氧化碳(CO)
| 氢气(H2)
| 甲烷(CH4)
| 乙醇(C2H5OH)
|
状态
| 固体
| 气体
| 气体
| 气体
| 液体
|
热量(kJ)
| 392.8
| 282.6
| 285.8
| 890.3
| 1 367
|
①从热量角度分析,目前最适合家庭使用的优质气体燃料是________。
②写出管道煤气中的一氧化碳燃烧热的热化学方程式_______________________
③充分燃烧1 mol表中各种燃料,排放出二氧化碳的量最多的是________。
④矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有________等。
参考答案:(21分)(1)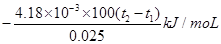 ?偏大?偏小(各2分)
?偏大?偏小(各2分)
(2)sp2杂化? 3? 1?(各1分)
(3)不,变浅?逆向?变深?不?不变?(各1分)
(4)(1)甲烷(1分)? (2)CO(g)+1/2O2(g)===CO2(g)? ΔH=-282.6 kJ·mol-1
(2分)
(3)乙醇(1分)? (4)氢能、太阳能(或风能、地热能)(1分)
本题解析:(1) ,CH3COOH为弱酸,在与NaOH溶液反应的过程中存在弱酸的电离,而电离吸热,放出的热量有一部分被吸收,所以放出的热量减少,但由于焓变前面有一个负号所得测得的焓变偏大,若将稀硫酸换成浓硫酸,由于浓硫酸稀释过程中会放热,所以放出的热量会增大,焓变前有一个负号所以测得的焓变偏小。
,CH3COOH为弱酸,在与NaOH溶液反应的过程中存在弱酸的电离,而电离吸热,放出的热量有一部分被吸收,所以放出的热量减少,但由于焓变前面有一个负号所得测得的焓变偏大,若将稀硫酸换成浓硫酸,由于浓硫酸稀释过程中会放热,所以放出的热量会增大,焓变前有一个负号所以测得的焓变偏小。
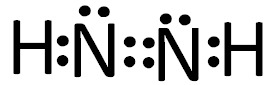
(2)每个N原子周围有5个电子,再加上氢原子的一个电子,每个N原子周围有6个电子,可以形成3对电子对,所以结合分子的结构可判断N采取的杂化方式为sp2杂化,电子式为

,由电子式可知1个分子中有3个σ键?,1个π 键。
(3)①增大容积,相当于减小压强,平衡向体积增大的方向移动,但是该反应前后体积没有发生变化,所以增大容积该平衡不发生移动,但是由于增大容积二氧化氮的浓度的减小,所以颜色变淡。②通入CO2气体,CO2的浓度增大平衡向逆向移动,反应混合物的颜色变深,若通人N2气体,平衡体系的压强增大但平衡不发生移动反应混合物的颜色不变。③催化剂对平衡无影响所以加入催化剂,平衡不移动。
(4)①从热量角度分析,等量的气体燃料甲烷燃烧放出的热量最多,所以此题填甲烷;
②一氧化碳燃烧热的热化学方程式CO(g)+1/2O2(g)===CO2(g)? ΔH=-282.6 kJ·mol-1
③充分燃烧1 mol表中各种燃料产生的二氧化碳的量炭粉(C)、一氧化碳(CO)、甲烷(CH4)都是1mol,氢气为0,乙醇为2mol,所以产生二氧化碳最多的是乙醇。
④绿色能源有太阳能、风能、氢能、潮汐能、地热能。
本题难度:一般