微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一个固定体积的密闭容器中,放入3升X(g)和2升Y(g),在一定条件下发生下列反应:
4X(g)+3Y(g)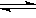 2Q(g)+nR(g) 达到平衡后,容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小1/3,则该反应式中的n值是
2Q(g)+nR(g) 达到平衡后,容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小1/3,则该反应式中的n值是
[? ]
A.3
B.4
C.5
D.6
参考答案:D
本题解析:
本题难度:一般
2、选择题 在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)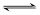 xC(g)符合下图(a)所示的关系(W(C)表示C的体积分数),由此推断关于图(b)的说法正确的是
xC(g)符合下图(a)所示的关系(W(C)表示C的体积分数),由此推断关于图(b)的说法正确的是
A.P3>P4,y轴表示A的转化率?B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的平均相对分子质量?D.P3>P4,y轴表示混合气体的密度
参考答案:A
本题解析:根据图像a可知,在温度相同的条件下,P2首先达到平衡状态,这说明P2大于P1。压强越大,C的含量越高,因此正方应是体积减小的可逆反应,即x=1。如果P3>P4,平衡向正反应方向移动,则反应物的转化率增大,因此y轴表示A的转化率,选项A正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终是不变的,D不正确;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,增大压强平衡向正反应方向移动,物质的量减小,则相对分子质量增大,所以选项C不正确;但B的含量不一定减小,选项B不正确,答案选A。
点评:该题是中等难度的试题,侧重对学生能力的培养和解题方法的指导与训练。该题需要注意的是在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)
本题难度:简单
3、选择题 一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是(?)
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是(?)
A.60s内X的平均反应速率为0.001 mol·L-1·s-1
B.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2
C.若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大
D.若升高温度,X的体积分数增大,则正反应的△H>0
参考答案:AC
本题解析:A、60s内X的平均反应速率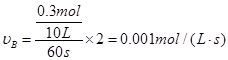 。
。
B、将容器的容积变为20L,则压强减小,平衡向气体体积增大的方向移动,因此Z的新平衡浓度将小于原平衡浓度的1/2。
C、若温度和体积不变,往容器内增加1molX,平衡正移,Y的转化率将增大。
D、若升高温度,X的体积分数增大,因反应前后气体体积发生变化,因此无法无法判断化学平衡的移动。
点评:对于化学平衡的考查,应特别注意平衡移动的影响因素以及平衡发生移动后对反应物生成物的百分含量以及反应热的大小关系。
本题难度:一般
4、填空题 现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。
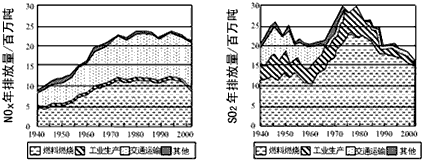
(1)结合上图数据,判断下列说法正确的是______。
A.在交通运输中排放的NOx与燃料的不充 91ExaM.org分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量下降,主要是减少了燃烧的煤的量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:____________________。
(3)汽车排放的尾气中含有未燃烧充分的碳氢化合物以及N2、CO2、NO、CO等。有人设计利用反应
2NO+2CO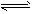 N2+2CO2将有害的污染物转化为可参与大气循环的N2和CO2。在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
N2+2CO2将有害的污染物转化为可参与大气循环的N2和CO2。在某温度下用气体传感器测得不同时间的NO和CO浓度如下表

在上述条件下反应能够自发进行,则反应的△H_____0(“>”、“<”或“=”)。前2h内的平均反应速率v(N2)=______。据此你认为将该反应从理论转化为现实的最重要的研究方向是______________。
(4)某次降雨过程收集到10 L的雨水,向雨水中滴加1 mL 6 mol/L的H2O2,充分反应后测得溶液的pH=3.62[c(H+)=2.4×10-4 mol/L,再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为
0. 1864g。若假设雨水的酸性仅由NOx和SO2的排放所致。请写出将H2O2加入到雨水中与含硫化合物反应的离子方程式______________,并计算排放到空气中的NOx和SO2的物质的量之比接近于_______。
参考答案:(1)BD
(2)CaCO3+SO2=CaSO3+CO2或2CaCO3+2SO2+O2=2CaSO4+2CO2
(3)<;1.875×10-4 mol·L-1·h-1;寻找高效的催化剂
(4)H2O2+SO2=2H++SO42-;1:1
本题解析:
本题难度:一般
5、选择题 已知真空炼铷的原理如下:2RbCl+Mg = MgCl2+2Rb(g)。对于此反应的进行能给予正确解释的是(? )
A.铷的金属活动性不如镁强,镁可置换出铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡向右移
C.铷的单质状态较化合态更稳定
D.MgCl2的热稳定性不如RbCl强
参考答案:B
本题解析:依据金属活泼顺序知:Rb>Na>Mg,是故A错;结合反应式中产物铷为气态,及时采取措施将铷抽走,使平衡向右移动,这样不断的进行下去,得到大量的铷,故B正确;铷属于活泼性最强的碱金属族,其单质的稳定性差,以化合态的形式存在于自然界中,故C错;MgCl2与RbCl的稳定性应离子键的强弱比较,由于MgCl2的离子键的形成的离子半径小且所带的电荷多,即离子键强,稳定性强,故D错。
本题难度:一般