微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 过氧乙酸是一种弱酸性氧化剂,广泛用作漂白剂和高效杀菌消毒剂等。
Ⅰ、制备:冰醋酸与H2O2浓溶液按体积比1:1混合,加入适量浓硫酸,控制温度5℃~30℃,搅拌30min并静置4~6h。
反应原理为:H2O2+CH3COOH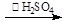
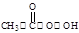 (过氧乙酸)+H2O
(过氧乙酸)+H2O
Ⅱ、含量测定:称取5.0000g过氧乙酸试样(液体),稀释至100mL备用。取上述稀释后过氧乙酸试样5.00mL,用0.0100 mol·L-1KMnO4溶液滴定到终点以除去其中的H2O2,随即加入10%KI溶液10mL,加入0.5%淀粉溶液3滴,摇匀,并用0.0500 mol·L-1Na2S2O3标准溶液滴定到蓝色刚好褪去(离子反应方程式为:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3标准溶液的总体积为20.00mL。
(1)制备过氧乙酸时,温度不宜过高,其原因可能是?。
(2)稀释样品时,除用到容量瓶及烧杯外,还用到的玻璃仪器有?、?。
(3)过氧乙酸溶液与KI反应的离子方程式为?。
(4)通过计算确定原试样中过氧乙酸的质量分数(写出计算过程)。?。
参考答案:
(1)温度过高,过氧化氢会发生分解;
(2)玻璃棒、胶头滴管。
(3)CH3COOOH+2H++2I-=I2+CH3COOH+H2O?
(4)
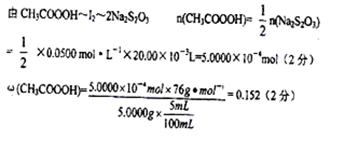
本题解析:(1)温度过高时过氧化氢会分解不能保证其和醋酸充分反应;(2)稀释样品时,还要用到胶头油管取液体,用玻璃棒在溶解时要搅拌。
(3)根据氧化还原反应原理,碘离子被氧化为碘单质,过氧乙酸溶液被还原为乙酸分子,故反应方程式如答案所示。
(4)根据两个化学方程式找出关系式如下:
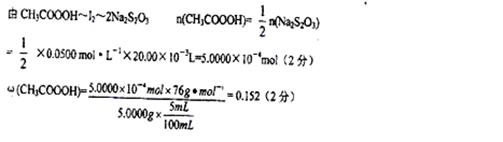
本题难度:一般
2、选择题 设NA表示阿伏加德罗常数的值,下列叙述中正确的是(?)
A.标准状况下,NA个SO3分子所占的体积约为22.4 L
B.在常温常压下,46 gNO2和N2O4混合物中所含原子的个数为3NA
C.1.8 g重水(D2O)中所含质子的个数为NA
D.7.8 g Na2O2固体中所含阴离子的总数为0.2 NA
参考答案:B
本题解析:标准状况下,三氧化硫不是气体,A不正确。B中二者的最简式相同,正确。C中1.8 g重水(D2O)的物质的量小于0.1mol,不正确。过氧化钠中阳离子和阴离子的个数之比是2︰1,因此7.8 g Na2O2固体中所含阴离子的总数为0.1 NA,答案选B。
本题难度:一般
3、填空题 (1)CO2的摩尔质量为?;
88 g CO2的物质的量为?,所含二氧化碳分子数为?,
在标准状况下的体积约为?。
(2)某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mgMg2+,则Mg2+的物质的量浓度为?。
(3)体积比为1∶1∶1的氯化钠、氯化镁和氯化铝溶液,分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,则这三种溶液的物质的量浓度之比为_________。
参考答案:(12分)(1)44 g·mol-1,2 mol, 2NA或1.204×1024个, 44.8L;
(2)1.9×10-3 mol·L-1。?(3)6:3:2?(每空2分)
本题解析:
(1)CO2的摩尔质量为44 g·mol-1;
88 g CO2的物质的量为2 mol,所含二氧化碳分子数为2NA或1.204×1024个,
在标准状况下的体积约为44.8L。
(2)某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mgMg2+,则Mg2+的物质的量浓度为1.9×10-3 mol·L-1。
(3)体积比为1∶1∶1的氯化钠、氯化镁和氯化铝溶液,分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,则这三种溶液的物质的量浓度之比为6:3:2。
点评:和物质的量有关的计算中常用的公式是:m=n×M;? v=n×vm?; N=NA×n; c=n/v,只要熟悉这些公式使用的条件和注意事项,此题便不难解决。
本题难度:一般
4、计算题 二氧化硫和氮氧化物(NOx)是大气的主要污染物,治理环境污染是当前环保工作的重要研究内容之一。
完成下列计算:
(1)石灰石-石膏湿法烟气脱硫工艺技术的原理是:烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4·2H2O)。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则理论上可得到_________吨石膏。
(2)用CH4催化还原NOx,主要产物为N2与CO2。现有1 L NOx(含NO2、NO),用CH4将其还原成N2,消耗同温同压下的CH4 0.4 L,则混合气体中NO2、NO的物质量之比为____。
(3)乙二酸(H2C2O4)的制备有如下反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6?+6HNO3→3H2C2O4+6NO↑+6H2O
上述反应产生的NOx用氧气和水吸收后生成硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克?
(4)用碱液吸收法处理某工业尾气(含NOx:NO、NO2和N2O4)的反应为:
2NO2 + 2NaOH→ NaNO2 + NaNO3 + H2O;
NO + NO2 + 2NaOH→ 2NaNO2 + H2O。
当N2O4体积分数为0.2时,处理1mol该NOx,计算生成NaNO3和NaNO2的物质的量(x可作为已知条件使用)。
参考答案:(1)38.7?(3分)
(2)3︰2?(3分)
(3)3.6?(4分)
(4)n(NaNO2)="(2.2-0.8x)" mol?(2分); n(NaNO3)="(0.8x-1)" mol?(2分)
本题解析:(1)根据硫元素守恒确定:300×2.5%×96%÷32×172=38.7t
(2)根据电子守恒得:3n(NO)+n(NO2)= 8n(CH4)? n(NO)+n(NO2)=1(单位用mol替代,方便计算)
2n(NO)+4n(NO2)= 8×0.4? n(NO)+n(NO2)=1
n(NO)=0.4mol? n(NO2)=0.6mol?则混合气体中NO2、NO的物质量之比为3︰2
(3)根据上述要求每生产9 kg需要硝酸的量计算为:
1/2n(NO) + 1/6n(NO2)= n(H2C2O4)=9000÷90=100
n(NO) :n(NO2)=1:2
联立解得n(NO)=120mol? n(NO2)=240mol
反应中气体损失10%,根据氮原子守恒知硝酸的量与气体的量相等,故应补充损失的量即可
(120+240)×63×10%÷63%=3600g=3.6kg
(4)设NO有amol,NO2有bmol
a+b=1-0.2=0.8
(a+2b)/(a+b)=x
解得a=1.6-0.8x? b=0.8x-0.8
根据方程式:NO + NO2 + 2NaOH→ 2NaNO2 + H2O,代入NO的物质的量(a),计算求出NaNO2的物质的量=3.2-1.6x
此时剩余NO2的物质的量=0.4+b-a=0.4+0.8x-0.8-(1.6-0.8x)=1.6x-2
根据方程式:2NO2 + 2NaOH→ NaNO2 + NaNO3 + H2O,带入NO2剩余的物质的量,计算求出n(NaNO2)= n(NaNO3)=0.8x-1
故亚硝酸钠的总量为两个方程式产生的和="3.2-1.6x+0.8x-1=2.2-0.8" x
本题难度:一般
5、选择题 将V?LHCl气体(标准状况)溶于水制得1?000mL盐酸溶液,该盐酸的物质的量浓度为( )
A.
?mol/L
B.?mol/L
C.?mol/L
D.?mol/L
参考答案:标况下,V?LHCl气体(标准状况)的物质的量=VL22.4L/mol=V22.4mol,溶液的体积为1L,所以盐酸的物质的量浓度为V22.4mol1L=V22.4mol/L,
故选C.
本题解析:
本题难度:简单