微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
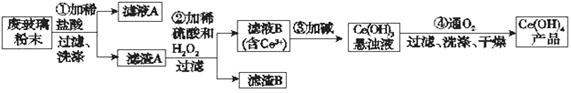
(1)洗涤滤渣A的目的是为了除去____________(填离子符号),检验该离子是否洗净的方法是_________________________________________________________。
(2)第②步反应的离子方程式是______________________________________,滤渣B的主要成分是___________________。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP______________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有_______________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________(结果保留两位有效数字)。
参考答案:(1) (共4分)? Fe3+(1分) 取最后一次洗涤液(1分),加入KSCN溶液(1分),若不出现红色,则已洗净(1分);反之,未洗净(其他合理答案均可)
(2) (共4分)? 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O(3分) (配平错扣2分、没有↑扣1分) SiO2(1分)? (3)不能 分液漏斗(各2分)? (4)97%或0.97( 4分)
本题解析:(1)废玻璃粉末中含有的二氧化铈和二氧化硅都是难溶于酸的,加入稀盐酸目的是溶解氧化铁等杂质,所以得到的滤渣主要是SiO2、CeO2 ,对滤渣进行洗涤就是要洗去残留的可溶性的Fe3+ 杂质,所以检验该离子是否洗净,应该取最后一次洗涤液,加入KSCN试剂,若不出现血红色现象,则证明已经洗涤干净,否则未洗净。
(2)滤渣A中的二氧化铈的Ce为+4价,而加入稀硫酸和H2O2后,固体CeO2 被溶解,且被还原为了+3价的Ce3+ ,所以可以看出加入的双氧水作还原剂,在性条件下发生氧化还原反应,方程式为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,所以得到的滤渣B是SiO2。
(3)化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,所以该萃取剂必须与水互不相容,在萃取分液操作中比需要用到分液漏斗。
(4)Ce(OH)4产品在用硫酸溶解后生成了Ce4+ ,所以用还原剂滴定该溶液,Ce4+ 变成了Ce3+ ,而Fe2+ 被氧化成了Fe3+ ,所以根据电子的是守恒计算,n(Ce(OH)4)=n(FeSO4)="cV=0.100" 0 mol·L-1×25.00 ×10-3 L=0.0025mol,所以Ce(OH)4的质量分数W=nM/m样品×100%=0.0025mol×208g/mol / 0.536g=97%。(要注意保留两位有效数字)。
本题难度:困难
2、选择题 下列物质中,含分子数最多的是
A.3.01×1023个N2
B.1 molO2
C.0.05 molHe
D.4 gH2
参考答案:D
本题解析:根据定义或相关计算关系可以计算出各自的物质的量,可得4 gH2的物质的量为2 mol,是最大值.
本题难度:困难
3、选择题 下列各物质中的少量杂质,可用括号内的试剂和方法除去的是( )
A.苯中溶有甲苯(高锰酸钾溶液,过滤)
B.甲烷中含有乙烯(溴水,洗气)
C.溴苯中溶有溴(苯,分液)
D.乙烷中含有乙烯(氢气,加成)
参考答案:A、甲苯能被高锰酸钾氧化为苯甲酸,但苯甲酸还能溶于苯中,除去了甲苯但引入了苯甲酸,而且不能通过过滤除去,故A错误;
B、甲烷不能和溴水反应,乙烯能和溴加成生成1,2-二溴乙烷,并留在洗气瓶中,故B正确;
C、溴苯中溶有溴,应加氢氧化钠溶液.溴苯和氢氧化钠不反应,溴能和氢氧化钠生成的盐不溶于溴苯,再分液即可,故C错误;
D、乙烷中含有乙烯,应该用溴水来洗气,而不能用氢气,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 下列实验方案设计正确的是? ( )
A.分解高锰酸钾制取氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B.失去标签的AgNO3溶液、稀盐酸、NaOH溶液、AlCl3溶液可选用(NH4)2CO3溶液作鉴别试剂
C.用铜丝代替铂丝做焰色反应
D.在裂化汽油中加入酸性高锰酸钾,振荡后若紫色褪去即可证明其中含甲苯等苯的同系物
参考答案:B
本题解析:加入(NH4)2CO3溶液时,AgNO3溶液中产生白色沉淀,稀盐酸中产生无色无味气体,NaOH溶液中产生无色有刺激性气味的气体,AlCl3溶液中既有白色沉淀又有无色无味气体产生。高锰酸钾分解后残留的二氧化锰可以用热的浓盐酸洗涤,不能用稀盐酸来清洗。做焰色反应实验应选用铂丝或铁丝,不能选用铜丝,因为铜丝灼烧时会产生明显的绿色火焰。裂化汽油中含有较多的烯、炔等不饱和烃,能使酸性高锰酸钾溶液褪色。
本题难度:一般
5、选择题 要除去CO2中混有的少量SO2气体,最好选用的试剂是
A.澄清石灰水
B.品红溶液
C.饱和NaHCO3溶液
D.溴水
参考答案:C
本题解析:除去CO2中混有的少量SO2气体,最好选用的试剂是饱和碳酸氢钠溶液,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生的应试能力。
本题难度:简单