微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4?、y mol?AgNO3溶液。据此得知原混合液中氯化钠的物质的量浓度(mol/L)为
A.(y-2x)/a
B.(y-x)/a
C.(2y-2x)/a
D.(2y-4x)/a
参考答案:D
本题解析:试题分析:根据题意,反应的有关方程式是Ba2++SO42-=BaSO4↓、Ag++Cl-=AgCl↓。所有溶液中Ba2+的物质的量是x mol、氯离子的物质的量是y mol。则根据溶液的电中性可知,每一份溶液中钠离子的物质的量是(y-2x)mol,所以氯化钠的总的物质的量是2(y-2x)mol,因此氯化钠的浓度是2(y-2x)mol÷a L,答案选D。
考点:考查物质的量浓度的有关计算
点评:该题容易错选A,这是由于忽略了溶液是均分2等份而导致的,所以准确的审清题目要求,也是成功的关键。
本题难度:困难
2、选择题 下列混合物的除杂方法与发生反应的类型均正确的是(?)
?
| 混合物
| 加入试剂或方法
| 反应类型
|
A
| 除去O2中的CO
| 通入炽热的氧化铜中
| 化合反应
|
B
| 除去CO2中的HCl
| 通入饱和碳酸氢钠溶液中
| 中和反应
|
C
| 除去碳酸钙中的碳酸钠
| 溶解、加入氯化钡溶液
| 复分解反应
|
D
| 除去氯化钠中的碳酸钠
| 加入适量盐酸、蒸发
| 复分解反应
|
?
参考答案:D
本题解析:A选项,CO会转化成新杂质CO2;B选项,碳酸氢钠与盐酸发生复分解反应;C选项,溶解、过滤即可得到纯净的碳酸钙。
本题难度:简单
3、选择题 0.5L 1mol/L的KCl溶液与0.2L 1 mol/L的Al Cl3溶液中,Cl-浓度比为
A.15∶2
B.1∶1
C.1∶3
D.3∶1
参考答案:C
本题解析:试题分析:根据氯化物的化学式可知,溶液中氯离子的浓度分别是1mol/L和3mol/L,则二者的氯离子浓度之比是1∶3,与溶液的体积无关系,答案选C。
考点:考查溶液中离子浓度的有关计算
点评:该题是基础性试题的考查,难度不大。试题注重基础,兼顾能力的培养。该题的关键是明确构成物质的离子以及相应的电离情况,另外还需要注意的是计算的浓度还是离子的物质的量,有利于培养学生的灵活应变能力。
本题难度:简单
4、填空题 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
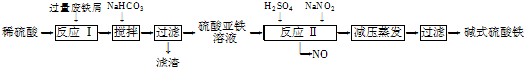
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
|
?
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为?。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为??___。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____?____。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
参考答案:(1) Fe + Fe2(SO4)2 = 2FeSO4
(2)Al3+ 加快反应速率(或使反应物充分接触,意思相近均给分)
(3) Fe2+ + NO2- + 2 H+ = Fe3+ + NO↑ + H2O?;氧化剂; 2 mol
(4) 2Fe(OH)2++2H2O Fe2(OH)42++2H+?
Fe2(OH)42++2H+?
(5)D(多选0分)
本题解析:(1)根据题意及流程图分析知,反应Ⅰ中发生的反应为Al2O3+3H2SO4=Al2(SO4)3+3H2O,Fe2O3+3H2SO4= Fe2(SO4)2+3H2O, Fe + Fe2(SO4)2 = 2FeSO4,Fe +H2SO4(稀)=FeSO4+H2↑,其中属于氧化还原反应的为Fe + Fe2(SO4)2 = 2FeSO4,(Fe +H2SO4(稀)=FeSO4+H2↑);(2)根据题意及流程图分析知,反应Ⅰ后溶液的成分为硫酸亚铁和硫酸铝的混合溶液,经搅拌、过滤后得硫酸亚铁溶液,所以加入少量NaHCO3的目的是调节pH,使溶液中的Al3+沉淀。该工艺流程中“搅拌”的作用是加快反应速率;(3)由题给信息知,反应Ⅱ中NaNO2中氮元素的化合价由反应前的+3价降为反应后NO中的+2,则硫酸亚铁中铁元素的化合价必然升高,由Fe2+转化为Fe3+,反应的离子方程式为Fe2+ + NO2- + 2 H+ = Fe3+ + NO↑ + H2O,反应Ⅱ的目的是利用氧化剂将Fe2+氧化为Fe3+,O2与NaNO2在反应中做氧化剂;n(O2)=0.5mol,则得到电子0.5mol×4=2mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,根据得失电子数目相等知,节约NaNO2的物质的量为 2mol;(4)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为
2[Fe(OH)]2++2H2O=[Fe2(OH)4]2++2H+;(5)A、氯水可以氧化亚铁离子为铁离子,溶液颜色变化不明显,不能检验亚铁离子,错误;B、KSCN溶液和亚铁离子混合无现象发生,不能检验亚铁离子,错误;C、NaOH溶液加入和铁离子反应生成红褐色沉淀不能检验是否存在亚铁离子,错误;D、在含有Fe3+的溶液中检验Fe2+,应选用酸性KMnO4溶液,现象明显,酸性KMnO4溶液氧化亚铁离子高锰酸钾溶液褪色,正确,选D。
本题难度:困难
5、填空题 ( 6分)除去下表各溶液中含有的少量杂质(括号内)填写下表:
物质(杂质)
| 除杂质所需试剂
| 离子方程式
|
Fe2O3(Al2O3)
| ?
| ?
|
FeCl2溶液(FeCl3)
| ?
| ?
|
NaHCO3溶液(Na2CO3)
| ?
| ?
参考答案:(试剂各1分,方程式各1分,共6分)
物质(杂质)
除杂所需试剂
离子方程式
FeO3(Al2O3)
NaOH溶液
Al2O3+2OH?=2AlO2?+H2O
FeCl2溶液(FeCl3)
铁粉
Fe+2Fe3+=3Fe2+
NaHCO3溶液(Na2CO3)
CO2气体
 +CO2+H2O= +CO2+H2O=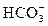
本题解析:略
本题难度:一般
|