微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4?、y mol?AgNO3溶液。据此得知原混合液中氯化钠的物质的量浓度(mol/L)为
A.(y-2x)/a
B.(y-x)/a
C.(2y-2x)/a
D.(2y-4x)/a
2、选择题 下列混合物的除杂方法与发生反应的类型均正确的是(?)
?
| 混合物
| 加入试剂或方法
| 反应类型
|
A
| 除去O2中的CO
| 通入炽热的氧化铜中
| 化合反应
|
B
| 除去CO2中的HCl
| 通入饱和碳酸氢钠溶液中
| 中和反应
|
C
| 除去碳酸钙中的碳酸钠
| 溶解、加入氯化钡溶液
| 复分解反应
|
D
| 除去氯化钠中的碳酸钠
| 加入适量盐酸、蒸发
| 复分解反应
|
?
3、选择题 0.5L 1mol/L的KCl溶液与0.2L 1 mol/L的Al Cl3溶液中,Cl-浓度比为
A.15∶2
B.1∶1
C.1∶3
D.3∶1
4、填空题 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
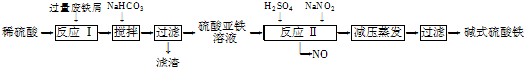
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
|
?
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为?。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为??___。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____?____。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
5、填空题 ( 6分)除去下表各溶液中含有的少量杂质(括号内)填写下表:
物质(杂质)
| 除杂质所需试剂
| 离子方程式
|
Fe2O3(Al2O3)
| ?
| ?
|
FeCl2溶液(FeCl3)
| ?
| ?
|
NaHCO3溶液(Na2CO3)
| ?
| ?
|