微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将等体积的0.1 mol·L-1 KHSO4溶液逐滴加入0.1 mol·L-1的Na2SO3溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中不正确的是
A.c(SO)>c(SO)>c(H+)>c(OH-)
B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=c(SO)+c(H2SO3)+c(HSO)+c(SO)
D.c(Na+)+c(K+)+c(H+)=2c(SO)+c(HSO)+c(OH-) +2c(SO)
参考答案:A
本题解析:H++SO32-=HSO3-,恰好完全反应,此时是0.1molSO42-和0.1molHSO3-的溶液,因为所得溶液能使紫色石蕊试液变红,溶液显酸性,HSO3-的电离程度大于水解程度,
A.错误,应为:c(SO)>c(H+)>c(SO)>c(OH-)
B 正确,由题意可知,钠离子浓度为0。2 mol·L-1,价钾离子浓度为0.1 mol·L-1,溶液显酸性,氢离子浓度大于氢氧根离子浓度
C正确,遵循物料守恒c(SO)+c(H2SO3)+c(HSO)="0.1" mol·L-1,c(SO)="0.1" mol·L-1,
c(Na+)="0.2" mol·L-1
D 正确,遵循质子守恒。
本题难度:一般
2、选择题 下列离子方程式正确的是(?)
A.Na2CO3溶液的水解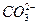 +2H2O
+2H2O H2CO3+2OH-
H2CO3+2OH-
B.金属铝溶于氢氧化钠溶液 Al+2OH-
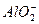 +H2↑
+H2↑
C.铜与浓硝酸反应 3Cu+8H++2
 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
D.次氯酸钙溶液中通入过量CO2 ClO-+CO2+H2O====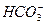 +HClO
+HClO
参考答案:D
本题解析:A中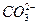 水解应分两步写。B项金属铝溶于氢氧化钠溶液的离子方程式为:2Al+2OH-+2H2O====
水解应分两步写。B项金属铝溶于氢氧化钠溶液的离子方程式为:2Al+2OH-+2H2O==== +3H2↑。C项铜与浓硝酸反应的离子方程式为Cu+4H++2
+3H2↑。C项铜与浓硝酸反应的离子方程式为Cu+4H++2 ?====Cu2++2NO2↑+2H2O。
?====Cu2++2NO2↑+2H2O。
本题难度:简单
3、选择题 对于0.1mol?L-1?NH4Cl溶液,正确的是( )
A.升高温度,溶液pH升高
B.通入少量HCl,c(NH4+)和c(Cl-)均增大
C.c(NH4+)+c(OH-)=c(Cl-)+c(H+)
D.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
参考答案:A.升高温度促进水解,NH4Cl水解,氢离子浓度增大,溶液pH降低,故A错误;
B.氢离子抑制氯化铵的水解,铵根浓度增大,加入了氯化氢,氯离子浓度增大,故B正确;
C.氯化铵不水解,铵根浓度与氢氧根相等,铵根水解,铵根浓度减少,氢离子浓度增大,故C错误;
D.水解程度很微弱,氢离子浓度小于铵根浓度,故D错误.
故选B.
本题解析:
本题难度:简单
4、填空题 某同学想把AlCl3溶液和Na2S溶液混合制取Al2S3,但最后得到一种白色絮状沉淀,并且混合液中有臭鸡蛋气味的气体放出。试解释造成此结果的原因,写出反应的离子方程式,并指出制取硫化铝的正确方法。
参考答案:Ⅰ?①增强②Fe2O3③减小减弱④溶液变红⑤生成无色气体,Mg片漂浮生成红褐色沉淀。
Ⅱ?在溶液中Al3+、S2-水解互相促进,发生剧烈水解。2Al3++3S2-+6H2O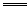 2Al(OH)3↓+3H2S↑H2S有臭鸡蛋气味。用S粉与Al粉(混合均匀)在干态时共热可制取Al2S32Al+3S
2Al(OH)3↓+3H2S↑H2S有臭鸡蛋气味。用S粉与Al粉(混合均匀)在干态时共热可制取Al2S32Al+3S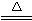 Al2S3
Al2S3
本题解析:Ⅰ?FeCl3溶液中存在下列平衡:
Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
加入NaOH中和H+,水解平衡右移。通入HCl(g)增大c(H+)使平衡左移,水解显酸性,滴入石蕊变红,加入MgCl2产生H2气泡,且平衡右移,生成Fe(OH)3沉淀。
蒸干FeCl3溶液,水解平衡右移,HCl挥发,生成Fe(OH)3沉淀,最后灼烧完全分解,所得固体为Fe2O3。
本题难度:简单
5、填空题 写出NaHCO3在水溶液中所发生的电离与水解反应的离子方程式,
?
?
?
并写出溶液中的电荷守恒的表达式?
溶液中的物料守恒(即原子守恒)的表达式?
参考答案:NaHCO3 = Na+ + HCO3-?HCO3- ?H+ + CO32-? HCO3- + H2O
?H+ + CO32-? HCO3- + H2O  ?OH- + H2CO3
?OH- + H2CO3
c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-) + c(OH-)? c(Na+)? = c(CO32-) + c(HCO3-) + c(H2CO3)
本题解析:碳酸氢钠在溶液中既存在电离平衡,也存在水解平衡,所以NaHCO3在水溶液中所发生的电离与水解反应的离子方程式有NaHCO3 = Na+ + HCO3-?、HCO3- ?H+ + CO32-、HCO3- + H2O
?H+ + CO32-、HCO3- + H2O  ?OH- + H2CO3;其电荷守恒和物料守恒的表达式分别是是c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-) + c(OH-)?、c(Na+)? = c(CO32-) + c(HCO3-) + c(H2CO3)。
?OH- + H2CO3;其电荷守恒和物料守恒的表达式分别是是c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-) + c(OH-)?、c(Na+)? = c(CO32-) + c(HCO3-) + c(H2CO3)。
点评:该题是基础性试题的考查,难度不大。试题紧扣教材,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣,提高学习效率。
本题难度:一般