微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应。
可能发生的反应有:
2Fe3++SO32-+H2O==2Fe2++SO42-+2H+(氧化还原反应)
2Fe3++3SO32-+6H2O==2Fe(OH)3(胶体)+3H2SO3(水解反应)
为了证明反应的实际情况,同学们设计并实施了下列实验,请填写下列空白:
实验I:
学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验的目的是____。
实验Ⅱ:
①取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 ____。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是___。将溶液分成两等份,其中一份加入KSCN稀溶液,溶液变成血红色,反应的离子方程式为____。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是____。
②换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ。与实验Ⅱ产生的现象完全相同。由上述实验得出的结论是____。
实验Ⅲ:
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是____。从形式上看,Na2CO3和Na2SO3相似。但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:① ____;②____。
参考答案:实验I:
检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4)
实验Ⅱ:
①氢氧化铁胶体(或胶体); 先产生红褐色 淀,后沉淀逐渐溶解,溶液变为黄色,有气泡产生;
Fe3++ 3SCN-==Fe(SCN)3? ;Ba2++SO42-==BaSO4↓
②Fe3+与SO32-同时发生氧化还原反应和双水解反应
实验Ⅲ:
2Fe3++ 3CO32-+3H2O==2Fe(OH)3↓+3CO2↑ ;
①SO32-有较强的还原性,CO32-没有还原性;②SO32-水解能力较CO32-小
本题解析:
本题难度:一般
2、选择题 下列有关实验原理或操作正确的是?
A.仅用硝酸银溶液便可鉴别亚硝酸钠和食盐
B.减压过滤是为了加快过滤速度,得到较大颗粒的晶体
C.硫酸亚铁铵晶体过滤后用无水乙醇洗涤
D.纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮
参考答案:C
本题解析:略
本题难度:一般
3、实验题 ?某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置去)。

(1)A中使用的药品是等物质的量的碳酸氧钠和碳酸氢铵,则在下列仪器中,A中未画出的仪器有?(填序号)。
①分液漏斗?②试管?③烧瓶?④酒精灯?⑤导管?⑥橡胶塞
(2)与装置B中的药品发生反应的物质有?(填化学式),装置c中发生催化氧化反应的化学方程式为?
(3)若A、B中药品足量,则装置D中可以观察到的现象自?。
(4)指导老师从安全与环保角度考虑.指出该装置有两处明显的缺陷,请你提出修改建议:?。
参考答案:(1)②④⑤⑥;(2)CO2,H2O;4NH3+5O2 ?4NO+6H2O;(3)铜片逐渐溶解并产生气泡,溶液变蓝色,气体在广口瓶上方变为红棕色;(4)在装置C、D之间增加一个防倒吸装置,在装置D后面增加一个尾气吸收装置。
?4NO+6H2O;(3)铜片逐渐溶解并产生气泡,溶液变蓝色,气体在广口瓶上方变为红棕色;(4)在装置C、D之间增加一个防倒吸装置,在装置D后面增加一个尾气吸收装置。
本题解析:(1)A中使用的药品碳酸氧钠和碳酸氢铵是固体,加热固体产生气体所需的仪器是②试管、④酒精灯、⑤导管和⑥橡胶塞;(2)由(1)中加热碳酸氧钠和碳酸氢铵产生CO2、H2O和NH3,与Na2O2反应的气体是CO2和H2O;在B中反应生成O2与NH3催化反应:4NH3+5O2 ?4NO+6H2O;(3)若A、B中药品足量,则C中反应生成的NO会与过量的O2反应生成NO2,NO2在D中与水反应生成HNO3,HNO3可与Cu反应,则会看到铜片逐渐溶解并产生气泡NO气体,生成Cu2+,溶液变蓝色,气体在广口瓶上方NO与O2反应生成NO2,气体变为红棕色;(4)装置C、D之间由于压强的原因,应在装置C、D之间增加一个防倒吸装置;装置D中产生的NO2有毒,污染空气,应在装置D后面增加一个尾气吸收装置。
?4NO+6H2O;(3)若A、B中药品足量,则C中反应生成的NO会与过量的O2反应生成NO2,NO2在D中与水反应生成HNO3,HNO3可与Cu反应,则会看到铜片逐渐溶解并产生气泡NO气体,生成Cu2+,溶液变蓝色,气体在广口瓶上方NO与O2反应生成NO2,气体变为红棕色;(4)装置C、D之间由于压强的原因,应在装置C、D之间增加一个防倒吸装置;装置D中产生的NO2有毒,污染空气,应在装置D后面增加一个尾气吸收装置。
本题难度:一般
4、实验题 试用简单的实验证明,在醋酸溶液中存在着CH3COO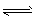 HCH3COO-+H+的电离平衡(要求写出简单操作、现象及实验能说明的问题)。
HCH3COO-+H+的电离平衡(要求写出简单操作、现象及实验能说明的问题)。
参考答案:在醋酸溶液中滴入紫色的石蕊试液,溶液呈红色,再向上述溶液中加入少量醋酸铵固体,振荡后,溶液颜色变浅,说明 c(H+)变小,原因是加入的CH3COO -使平衡向左移动,由此说明醋酸溶液存在着醋酸的电离平衡。
本题解析:
本题难度:一般
5、选择题 以下是对某溶液进行离子检验的方法和结论,其中正确的是( )
A.先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42-
B.加入足量的CaCl2溶液,产生了白色沉淀,则溶液中一定含有大量的CO32-
C.加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32-
D.先加适量的硝酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀,则溶液中一定含有大量的Cl-
参考答案:A、能和氯化钡反应生成不溶于强酸的白色沉淀可能是氯化银,也可能是硫酸钡,硝酸具有强氧化性,能把亚硫酸钡氧化生成硫酸钡,所以原溶液中可能存在的离子是SO42-或SO32-或Cl-,也可能是SO42-、SO32-、Cl-中的两种或三种,故A错误;
B、能和氯化钙反应生成白色沉淀的阴离子有碳酸根离子、银离子,所以原溶液中可能存在的离子是碳酸根离子或银离子,故B错误;
C、能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,所以原溶液中可能存在的离子可能是碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子,故C错误;
D、先将溶液用硝酸酸化后,排除了碳酸根离子的干扰,然后再加入硝酸银溶液,能产生白色沉淀的阴离子是氯离子,故D正确.
故选D.
本题解析:
本题难度:简单