微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 火柴头上通常含有氯酸钾、二氧化锰、硫等物质。某研究性学习小组进行火柴头中有关物质的实验探究。
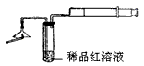
(1)检验火柴头中含有硫 将两根火柴放在如下图所示实验装置中漏斗下面,用一根燃着的火柴点燃,慢慢拉动注射器活塞抽气,让火柴燃烧产生的气体通过稀品红溶液,观察到品红溶液褪色。据此回答下列问题:
①燃烧产生的气体中一定含有___________
②可用于替代试管中品红溶液的试剂有___________(填标号)
A.稀高锰酸钾酸性溶液 B.饱和石灰水 C.稀溴水 D.烧碱溶液
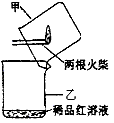
③某同学提出用如下图所示方法进行实验更为简便。他的操作是:
ⅰ、当图中所示火柴头燃烧完,立即移出火柴;
ⅱ、__________________________
(2)测定火柴头中氯酸钾的含量主要实验步骤如下:
ⅰ、刮取火柴头,小心研碎,称得质量为2.45g;
ⅱ、用适量蒸馏水充分浸泡后过滤、洗涤残渣;
ⅲ、往装有滤液和洗涤液的烧杯中加入过量的NaNO2溶液、AgNO3溶液和稀硝酸,搅拌,充分反应后,过滤、洗涤沉淀;
ⅳ、干燥沉淀物,称得其质量为1.435g
①实验中发生的反应是:KClO3+3NaNO2+AgNO3==AgCl↓+3NaNO3+KNO3其中NaNO2是_______剂;反应中AgNO3、NaNO2均需要过量的原因是_______________________
②实验测得火柴头中KClO3的质量分数为_______________
③如果第ⅱ步中未洗涤残渣,测得KClO3的质量分数将____________(填偏大、偏小或无影响,下同);如果第ⅲ步中,未洗涤AgCl沉淀,测得KClO3的质量分数将____________
参考答案:(1)①SO2(或二氧化硫);②AC;③迅速将甲烧杯扣在乙烧杯上,充分振荡乙烧杯
(2)①还原;确保KClO3中氯元素全部转化为AgCl沉淀;②50%;③偏小;偏大
本题解析:
本题难度:困难
2、实验题 某化学小组为测定加碘盐中KIO3的质量分数,进行了如下实验。
已知:KIO3 + 5KI + 3H2SO4= 3K2SO4 + 3I2 + 3H2O
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
步骤一:准确称取a g加碘盐,配制成250mL溶液;
步骤二:取所配制溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量的KI溶液;
步骤三:用bmol·L-1 Na2S2O3溶液的溶液滴定步骤二所得溶液至终点,记录数据;再重复滴定2次,平均消耗Na2S2O3溶液的体积为12.00mL。
(1)步骤一中配制250mL溶液,所用到的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还有?。
(2)步骤三中进行滴定的过程中下列哪个操作正确?,

选择?作为指示剂,到达滴定终点时的现象为?。
(3)实验测得此加碘盐中KIO3的质量分数=?(KIO3的相对分子质量为214)。
参考答案:
(1)250mL容量瓶
(2)B?淀粉?
当滴入最后一或半滴Na2S2O3溶液时,溶液的蓝色褪去,且半分钟内溶液不恢复蓝色。
(3)(4.28b)/a × 100%
本题解析:(1)配制250mL溶液用到的仪器有托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、量筒(可用可不用),故还需要的玻璃仪器有:250mL容量瓶,故答案为:250mL容量瓶;
(2)硫代硫酸钠显碱性,应使用碱式滴定管,因此选B。硫代硫酸钠遇到碘单质被碘氧化,可以使碘变成碘离子,因此使用淀粉作指示剂。到达滴下终点时的现象为:当滴入最后一或半滴Na2S2O3溶液时,溶液的蓝色褪去,且半分钟内溶液不恢复蓝色。
(3)25mL溶液消耗Na2S2O3的物质的量为b?mol?L-1×0.012L=0.012mol,故250mL溶液应消耗Na2S2O3的物质的量为0.012bmol×10=0.12bmol,令250mL溶液中KIO3的物质的量为xmol,则:
KIO3~~~~3I2~~~~6Na2S2O3
1? 6
xmol?0.12bmol
所以x=0.02b
故加碘盐中KIO3的质量分数: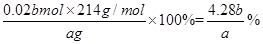
本题难度:一般
3、选择题 下列有关实验操作或仪器的使用正确的是?

A? B? C? D
A.除去氯气中的氯化氢
B.制备Fe(OH)2
C.实验室制备氨气
D.保存浓硝酸
参考答案:C
本题解析:A、氯气和氯化氢均与氢氧化钠反应,错误;B、四氯化碳密度大于水,不能在水面隔离空气,错误;C、正确;D、浓硝酸具有强氧化性,不能用橡皮塞,见光易分解,应放棕色瓶避光保存,错误。
本题难度:简单
4、实验题 用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1mol/L的溶液100mL
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察观象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是______________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH________1(选填>、<、=) 乙方案中,说明HA是弱电解质的现象是________(多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快,
(3)请你评价:乙方案中难以实现之处和不妥之处________、________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
________________________________
参考答案:(1)100mL容量瓶
(2)>;b
(3)配制pH=1的HA溶液难以实现;加入的锌粒难以做到表面积相同
(4)配制NaA溶液,测其pH值>7即证明HA是弱电解质
本题解析:
本题难度:一般
5、实验题 (21分)用98%的浓H2SO4(ρ=1.84g/cm3)配制 240mL0.5mol/L的稀H2SO4,请按要求填空:
(1)请写出该实验的实验步骤
①?,②?,③?,④?,⑤?。
(2)所用浓H2SO4的物质的量浓度为 ?,配制时所需浓硫酸的体积为?mL。(均保留一位小数)
(3)实验中需要用到的定量仪器有(包括规格)?
(4)若实验中出现下列 现象对所配溶液的浓度有什么影响?(填“偏高”、“偏低”或“无影响”)
现象对所配溶液的浓度有什么影响?(填“偏高”、“偏低”或“无影响”)
①浓硫酸溶解后未冷至室温即进行转移、定容。(?)
②定容时俯视刻度线。(?)
(5)若定容时液面高于刻度线应采取的措施是?。?
(6)若实验操作全部无误,最后所得的溶液应存放在试剂瓶中,并贴上标签,请你帮助把标签上的内容写一下(如右图)。
参考答案:

本题解析:略
本题难度:一般