|
高中化学必备知识点《盐类水解的原理》高频考点巩固(2017年模拟版)(八)
2017-07-10 18:27:35
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关有机物的说法正确的是( )
A.石油裂化和油脂皂化都是高分子生成小分子的过程
B.2-丁醇经消去反应后共得到两种有机物,其中一种的名称是顺-2-丁烯
C.含有6个碳原子的有机物,每个分子中最多可形成5个C-C单键
D.高分子化合物
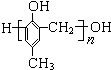
可由对甲基苯酚与甲醛聚合生成
参考答案:D
本题解析:
本题难度:一般
2、选择题 化学用语是学习化学的重要工具,下列化学用语中正确的是
A.Na2S的水解:S2-+ 2H2O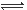 H2S + 2OH- H2S + 2OH-
B.NaHCO3的电离:NaHCO3 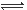 Na + + H+ + CO32- Na + + H+ + CO32-
C.HSO3-的电离:HSO3- 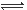 H+ + SO32- H+ + SO32-
D.钢铁的电化学腐蚀的负极反应式:Fe-3e-Fe3+
|
参考答案:C
本题解析:S2-的水解要分两步进行,A错;HCO3-是一个整体不能拆开,NaHCO3 是强电解质,完全电离,B错;HSO3-在溶液中主要以电离为主,C正确;钢铁的电化学腐蚀的负极反应式应该是:Fe-2e- Fe2+,D错。
考点:电离、水解的离子方程式、金属腐蚀的电极反应。
本题难度:一般
3、简答题 (10分)(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液中,设由水电离产生的OH-的物质的量浓度分别为A和B,则A________B(填“>”、“=”或“<”)。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若向该溶液中再滴入过量的BaCl2溶液,所观察到的现象是_________________________,其原因是_________________________。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是_______________。
②若为弱酸强碱盐,其第一步水解的离子方程式是___________________________。
参考答案:(10分)(1);<
(2)产生白色沉淀,红色逐渐褪去(两个现象各1分,意思对就给分);
钡离子与碳酸根离子结合成为难溶的碳酸钡,从而抑制了碳酸根离子的水解。(意思对就给分)
(3)An++nH2O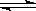 A (OH)n+nH+ Bm-+H2O A (OH)n+nH+ Bm-+H2O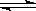 HB (m-1)- + OH- HB (m-1)- + OH-
本题解析:(1)氢氧化钠溶液中,存在大量的氢氧根离子,对水的电离起抑制作用,而醋酸钠溶液中,醋酸根离子水解,对水的电离起促进作用,所以水电离产生的氢氧根离子的浓度A<B;
(2)纯碱为碳酸钠,因为碳酸根离子水解使溶液呈碱性,所以加入酚酞试液变红色,再滴入氯化钡溶液,因为钡离子与碳酸根离子结合为碳酸钡沉淀,使碳酸根离子的浓度减小,碳酸根离子的水解平衡逆向移动,溶液的碱性减弱,所以红色逐渐褪去,且产生白色沉淀;
(3)对于强酸弱碱盐水解时,弱碱的阳离子水解的离子方程式一步写成,所以水解的离子方程式是An++nH2O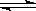 A (OH)n+nH+;对于弱酸强碱盐水解时,弱酸根离子的水解是分步写的,所以第一步水解的离子方程式是Bm-+H2O A (OH)n+nH+;对于弱酸强碱盐水解时,弱酸根离子的水解是分步写的,所以第一步水解的离子方程式是Bm-+H2O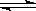 HB (m-1)-+OH-。 HB (m-1)-+OH-。
考点:考查条件对水电离的影响,水解离子方程式的书写
本题难度:困难
4、选择题 25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如右图所示。下列有关溶液中离子浓度关系叙述正确的是
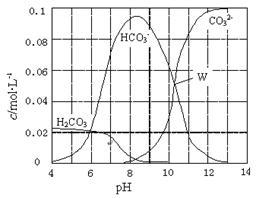
A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-)
B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32?-)<0.1 mol·L-1
C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32?-)>c(HCO3-)>c(H2CO3)
参考答案:B
本题解析:试题分析:根据电荷守恒可知,溶液中离子应该满足关系式c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) + c(HCO3-),A不正确;pH=4,说明反应中一点有CO2生成,所以根据物料守恒可知c(H2CO3)+ c(HCO3-)+ c(CO32?-)<0.1 mol·L-1,B正确;根据图像可知pH=8时,溶液中碳酸氢钠的远远大于碳酸钠的浓度,这说明反应中恰好是生成碳酸氢钠,则根据物料守恒可知c(H2CO3)+ c(HCO3-)+ c(CO32?-)=c(Cl-)=1/2 c(Na+),则c(H+)+ 2c(H2CO3)+ 2c(HCO3-) = c(OH-)+c(Cl-),C不正确;根据图像可知pH=11时,溶液碳酸钠的浓度远远大于碳酸氢钠的浓度,这说明碳酸钠是过量的,则c(Na+)>c(CO32?-) >c(Cl-)>c(HCO3-)>c(H2CO3),D不正确,答案选B。
考点:考查碳酸钠和盐酸反应中离子浓度大小比较
点评:该题是高考中的常见题型,属于综合性试题的考查,对学生的思维能力提出了较高的要求,本题贴近高考,综合性强,侧重对学生能力的培养,意在培养学生的逻辑推理能力和创新思维能力。该题的关键是在明确反应原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合图像和题意灵活运用即可。
本题难度:一般
5、选择题 为了配制CH3COO-与Na+浓度比为1∶1的溶液,可向CH3COONa溶液中加入
A.适量盐酸
B.适量NaOH固体
C.适量KOH
D.适量NaCl晶体
参考答案:C
本题解析:应加入物质来抑制醋酸根的水解反应,即应加入碱性物质,但注意不能加入含有钠离子的碱.
本题难度:简单
|