微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 细菌冶金是一种新工艺,其能耗少、减少环境污染.称为“绿色冶金”。其原理:①氧化硫硫杆菌和聚硫杆菌能把矿石中的硫氧化成硫酸,反应式为2S+3O2+2H2O?2H2SO4,②氧化亚铁硫杆菌在上面产生的硫酸中能把硫酸亚铁氧化成硫酸铁③细菌得到了所需要的能量,生成的硫酸铁可把FeS2(黄铁矿)和Cu2S(辉铜矿)等转变为可溶性化合物而从矿石中溶解出来,其化学过程是:
Fe2S2(黄铁矿)+7Fe2(SO?4)3+8H2O?15FeSO4+ 8H2SO4
Cu2S(辉铜矿)+2Fe?2(SO4)2?2CuSO4+4FeSO4+S
(1)写出②反应的化学方程式:?。
(2)某实验小组,欲将硫酸铜和硫酸亚铁的酸性混合液分离出硫酸亚铁溶液.经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如表2
物质
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
|
开始沉淀pH
| 6.0
| 7.5
| 1.4
|
沉淀完全pH
| 13
| 14
| 3.7
|
实验室有下列试剂可供选择A.H2O2 ?B.CaO? C.CuO? D.稀H2SO4?E.铁粉;?
实验经过滤后还需设计的实验操作步骤和目的是:
实验步骤
| 实验操作
| 实验操作的目的
|
步骤1
| ?
| ?
|
步骤2
| ?
| ?
|
步骤3]
| ?
| ?
|
步骤4
| 洗涤
| ?
|
步骤5
| ?
| 得到FeSO?4溶液
|
(3)若向CuSO4、FeSO4混合液中加入适量碱液,将溶液蒸干、灼烧得到红色粉末是Fe2O3、Cu2O混合物,欲测定该混合物中Cu2O的质量分数。该实验小组的方法是向m g混合物中加人足量的稀硫酸,经过滤、洗涤、干燥、称量固体的质量为n g。已知Cu2O溶于稀硫酸生成Cu和CuSO4。某学生据此计算出该混合物Cu2O的质量分数的计算式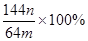 。该学生的计算是否正确:?,请说明理由?。
。该学生的计算是否正确:?,请说明理由?。
参考答案:(14分)1、4FeSO4+2H2SO4+O2=2Fe2(SO4)3+2H2O(2分)
(2)
实验步骤
实验操作
实验操作的目的
步骤1
加入H2O2
把二价铁氧化成三价
步骤2
加入适量氧化铜,调节pH到3.7
保证三价铁完全沉淀
步骤3
过滤
滤出氢氧化铁
步骤4
洗涤沉淀
除去杂质
步骤5
向沉淀中加入适量稀硫酸和适量铁粉
得到FeSO4溶液
(3)不正确(2分),因为该计算没有考虑Cu与Fe3+的反应(2分)
本题解析:(1)根据反应物和生成物可知,该反应的方程式是4FeSO4+2H2SO4+O2 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(2)pH>3.7时,Fe(OH)3已沉淀完全,而pH=6.0时Cu(OH)2才开始沉淀,则可以通过调节溶液的pH使铁元素、铜元素分离。分离时,首先将Fe2+氧化为Fe3+,氧化剂选择H2O2较好,没有杂质引入;再调节溶液的pH,选择的试剂既要消耗H+又不引入杂质,选择CuO最合适;最后需将Fe(OH)3沉淀转化为FeSO4溶液,选择稀硫酸和铁粉即可。
(3)Fe2O3、Cu2O溶于足量稀硫酸发生的反应有:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Cu2O +H2SO4 Cu+CuSO4+H2O,Cu+Fe2(SO4)3=2FeSO4+CuSO4。
本题难度:一般
2、选择题 最近广东北江发生严重的水体镉污染事件,专家确定用1200t的聚合铁{简称PFS,化学式为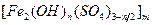 ,
,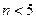 ,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是
,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是
A.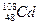 核素中中子数为60
核素中中子数为60
B.含镉废电池应进行回收处理
C.PFS中铁显+2价
D.实验室由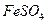 溶液制PFS需经过氧化、水解和聚合的过程
溶液制PFS需经过氧化、水解和聚合的过程
参考答案:C
本题解析:设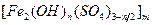 中铁元素化合价为x,,得
中铁元素化合价为x,,得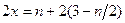 ,得
,得 。
。
本题难度:一般
3、选择题 向200 mL 0.1mol/L 的Fe(NO3)2溶液中加入一定量NaOH,使Fe2+完全沉淀,加热、蒸干并灼烧混合物直至质量不再变化,此时固体的质量可能为
A.1.60 g
B.2.76 g
C.4.36 g
D.5.54 g
参考答案:CD
本题解析:略
本题难度:一般
4、填空题 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适的反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的。请回答:
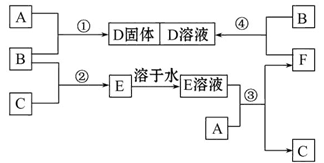
(1)A是_______、B是_______、C是_______ (请填化学式)。
(2)反应①的化学方程式为: ___________________________________。
(3)反应③的离子方程式为: _________________________________________。
(4)反应④的离子方程式为:___________________________________________。
参考答案:(1)Fe? Cl2? H2
(2)2Fe+3Cl2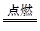 2FeCl3
2FeCl3
(3)2H++Fe=Fe2++H2↑
(4)2Fe2++Cl2=2Fe3++2Cl-
本题解析:本题的突破口是B为黄绿色气体。据中学所学知识可知,B为Cl2。结合B(Cl2)+C(无色气体)→E→E溶液,可推测C为H2,E为HCl。再结合:A(s)+B(Cl2) →D(s); E(溶液)+A(s) →C(H2)+F;F+B(Cl2) →D(溶液),可推测A为Fe,F为FeCl2,D为FeCl3。
本题难度:一般
5、选择题 有一种物质俗称铁红,常用作红色油漆和涂料,它的化学式为(? )
A.FeO
B.Fe2O3
C.Fe
D.Fe3O4
参考答案:B
本题解析:
铁在吸氧腐蚀时产生铁锈,此为原电池原理,负极2Fe-4e-=2Fe2+,正极4e-+O2+2H2O=4OH-,总反应式2Fe+O2+2H2O=2Fe(OH)2,氢氧化亚铁被空气中的氧气氧化为氢氧化铁,氢氧化铁再分解生成氧化铁Fe2O3,这是红色物质,俗称铁红。
本题难度:简单