| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《热化学方程式》考点预测(2017年强化版)(四)
参考答案:D 本题解析:根据盖斯定律,一式-二式×3得+489.0-172.5×3=-28.5 kJ·mol-1,热化学方程式为Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ·mol-1,选D。 本题难度:一般 4、填空题 (12分)氮元素可以形成多种氢化物,如NH3、N2H4等。
②已知原料气中的氨碳比  为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处,NH3的平衡转化率为__________。 为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处,NH3的平衡转化率为__________。 (3)①在氢水加水稀释的过程中,NH3·H2O的电离程度____(填“增大”、“减小”或“不变”,下同), 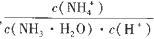 的值__________。 的值__________。②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是__________________(用离子方程式表示),该反应的平衡常数为__________(用含a的数学表达式表示)。 参考答案:(1)2N2H4(g)+N2O4(g) 本题解析:(1)由①N2(g)+O2(g)=2NO(g)△H=+180.7kJ?mol-1 本题难度:困难 5、填空题 (1)已知红磷比白磷稳定,又知:4P(白磷,s)+5O2(g)=2P2O5(s) △H1; 参考答案:(共6分)< (2)3H2(g)+CO2(g)=CH3OH(l+H2O(l) △H=-130.9 kJ/mol (3) 本题解析:(1)红磷比白磷稳定,这说明红磷的总能量低于白磷的总能量,即红磷转化为白磷是吸热反应,△H>0。根据反应①4P(白磷,s)+5O2(g)=2P2O5(s) △H1和②4P(红磷,s)+5O2(g)=2P2O5(s) △H2,依据盖斯定律可知,②-①即得到反应4P(红磷,s)=4P(白磷,s),则该反应的△H=△H2-△H1>0,所以△H1<△H2。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《物质的量》试题巩.. | |