微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 (12分) 以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:

(1)图中“沉铁”化学方程式为?。
(2)图中“过滤”后滤液中金属阳离子除了含有的Al3+,还含有??(填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为?。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] 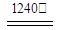 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过图9所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过图9所示的装置。


①集气瓶中收集到的气体是??(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有??(填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为?。
参考答案:(1)2K4[Fe(CN)6]+ Fe 2(SO4)3 = 2KFe[Fe(CN)6]↓+3K2SO4(2分)
(2)Fe2+ Fe3+(2分)
(3)2Fe2++H2O2+2H+ = 2Fe3++2H2O(2分)
(4)①N2(2分)②SO3、NH3(2分,缺漏不给分)。
③2MnO4- +5SO2 + 2H2O = 2Mn2+ + 5SO42-+4H+(2分)
本题解析:(1)由K4[Fe(CN)6]生成KFe[Fe(CN)6];(2)铁的氧化物和氧化铝溶于酸,二氧化硅不溶形成滤渣;(3)溶液中的亚铁离子不易除去,需把其氧化为铁离子再沉淀除去;(4)①通过饱和亚硫酸氢钠溶液除去氨气、三氧化硫,通过高锰酸钾溶液除去二氧化硫气体,故收集的气体为氮气;②SO3、NH3均溶解于水与水反应;③KMnO4溶液与二氧化硫反应,二氧化硫被氧化为硫酸根离子。
本题难度:一般
2、实验题 (本题共12分)
我国利用生产磷铵[(NH4)3PO4]排放的废渣磷灰石制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是Ca3(PO4)2,具体生产磷铵流程如下:

38.操作a的名称是___________,实验室中进行此操作的非玻璃仪器用品有___________;在实验室中操作b的名称是______________________。
39.装置a中生成两种酸式盐,它们的化学式分别是_______________________。
40.固体A中一定含有的物质,其化学式是_________________。
41.热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是________________________。
42. 制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是__________。
a.NaOH溶液、酚酞试液? b.KMnO4溶液、稀硫酸
c. 碘水、淀粉溶液? d.氨水、酚酞试液
所用的测量方法为?。
参考答案:
38.?过滤 (1分)?铁架台(含铁圈)、滤纸?(1分)?蒸发浓缩、冷却结晶(2分)
39.? NH4H2PO4、(NH4)2HPO4?(2分)
40.? CaSO4·2H2O?(2分)?
41.?冷凝管?(1分)
42.? b、c?(2分) (氧化还原)滴定法(1分)
本题解析:38.固液分离用过滤操作,操作中用到漏斗、玻璃棒、烧杯和铁架台、滤纸等;从滤液中得到晶体应采用蒸发浓缩、冷却结晶的方法,铵盐稳定性差,不宜采用蒸发结晶;39.磷酸为三元酸,生成两种酸式盐;40.磷酸钙与硫酸反应生成磷酸和硫酸钙,故A中一定含有硫酸钙晶体;42.利用SO2的还原性采用滴定法测定其含量,可以用氧化剂酸性KMnO4溶液、碘水等氧化。
本题难度:一般
3、选择题 利用下列实验装置进行的相应实验,能达到实验目的的是
A.图1所示装置可制备氨气
B.图2所示装置可分离CH3CH2OH和CH3COOC2H5的混合液
C.图3所示装置可制备、收集乙烯并验证其易被氧化
D.图4所示装置可制备氧气
参考答案:AD
本题解析:A、生石灰与水反应生成氢氧化钙增大氨水中的氢氧根离子浓度,抑制一水合氨的电离,有利于氨气的逸出,同时生石灰溶于水放热,减小氨气的溶解度,所以可以用该装置制备氨气,正确;B、CH3CH2OH和CH3COOC2H5互溶,不分层,不能分液,错误;C、乙醇在浓硫酸作催化剂、加热条件下发生消去反应生成乙烯,而图中是稀硫酸,错误;D、过氧化氢在二氧化锰作催化剂条件下分解产生氧气,二氧化锰固体放在圆底烧瓶里,过氧化氢放在分液漏斗里,正确,答案选AD。
本题难度:一般
4、实验题 (10分)实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为?。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯?。
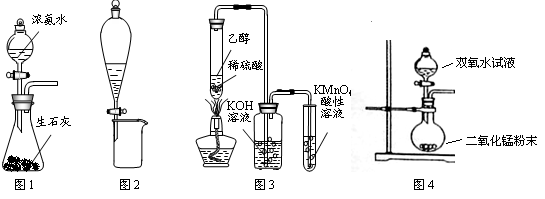
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为??g,要完成本实验该同学应称出?g NaOH。
(3)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是__________。
①没有洗涤烧杯和玻璃棒?
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水?
④定容时俯视刻度线?
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞摇匀,静置后,液面低于刻度线,再加水至刻度线。
参考答案:(1)②①③⑧⑤⑥⑦④、250mL容量瓶、胶头滴管(容量瓶未注明250ml不得分)
(2)27.4g ?10.0g?(各2分)
(3)④⑤(2分)
本题解析:m(NaOH)=1.0mol/L×0.25L×40g/mol= 10.0g ,因为要配制250mL、没有240mL容量瓶。?①没有洗涤烧杯和玻璃棒?②转移溶液时不慎有少量洒到容量瓶外面都会导致溶质变少,结果偏小。③容量瓶不干燥,含有少量蒸馏水对结果没有影响。?定容时高偏高低偏低,⑤未冷却到室温就将溶液转移到容量瓶并定容导致水加少了,浓度偏高,⑥定容后塞上瓶塞摇匀,静置后,液面低于刻度线,再加水至刻度线。水加多了浓度偏小。
本题难度:一般
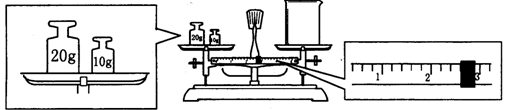
5、实验题 单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解 ,有关物质的物理常数见下表:
,有关物质的物理常数见下表:
物质
| SiCl4
| AlCl3
| FeCl3
|
沸点/℃
| 57.7
| -
| 315
|
熔点/℃
| -70.0
| -
| -
|
升华温度/℃
| -
| 180
| 300
|
?
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________, 装置D的硬质玻璃管中发生反应的化学方程式是?。
 (2)装置C中的试剂是?; D、E间导管短且粗的原因是?。
(2)装置C中的试剂是?; D、E间导管短且粗的原因是?。
 (3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3:?。
【设计方案,进行实验】可供选择的实验试剂有:3?mol/L?H2SO4、1?mol/L?NaOH、0.01?mol/L?KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
序号
| 操?作
| 可能出现的现象
| 结论
|
①
| 向a试管中滴加几滴?溶液
| 若溶液褪色
| 则假设1成立
|
若溶液不褪色
| 则假设2或3成立
|
②
| 向b试管中滴加几滴?溶液
| 若溶液褪色
| 则假设1或3成立
|
若溶液不褪色
| 假设2成立
|
③
| 向c试管中滴加几滴?溶液
| ?
| 假设3成立
|
?
参考答案:(1)MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O ;SiO2+2C+2Cl2
Mn2++Cl2↑+2H2O ;SiO2+2C+2Cl2 SiCl4+2CO
SiCl4+2CO
(2)浓硫酸;防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管
(3)【提出假设】假设3:只有ClO-【设计方案,进行实验】①溴水(或0.01?mol/L?KMnO4溶液)②品红溶液;③淀粉-KI溶液;若溶液变为蓝色
本题解析:(1)装置A中发生的反应是用高锰酸钾和浓盐水在加热的条件下制备氯气,其反应离子方程式MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O;氯气经过除杂后在D中和SiO2与C在加热条件下进行反应生成SiCl4和CO,反应化学方程式SiO2+2C+2Cl2
Mn2++Cl2↑+2H2O;氯气经过除杂后在D中和SiO2与C在加热条件下进行反应生成SiCl4和CO,反应化学方程式SiO2+2C+2Cl2 SiCl4+2CO(2)BC中分别为饱和食盐水和浓硫酸用来除去氯气中的HCl和水蒸气;石英砂中的铁、铝等杂质也能转化为相应氯化物,若导管较细使杂质凝结成固体堵塞导管(3)由假设1和假设2得知,要检测的为SO32-和ClO-,故假设3为只有ClO-;又因为SO32-会使KMnO4和溴水,并不与ClO-发生反应,故可以用来检测假设1,而均SO32-和ClO-具有漂白性,会使品红溶液褪色,故可以用来检测假设2;所有试剂中ClO-可以氧化KI使其生成I2,在淀粉溶液中显蓝色,可以用来检测假设3。
SiCl4+2CO(2)BC中分别为饱和食盐水和浓硫酸用来除去氯气中的HCl和水蒸气;石英砂中的铁、铝等杂质也能转化为相应氯化物,若导管较细使杂质凝结成固体堵塞导管(3)由假设1和假设2得知,要检测的为SO32-和ClO-,故假设3为只有ClO-;又因为SO32-会使KMnO4和溴水,并不与ClO-发生反应,故可以用来检测假设1,而均SO32-和ClO-具有漂白性,会使品红溶液褪色,故可以用来检测假设2;所有试剂中ClO-可以氧化KI使其生成I2,在淀粉溶液中显蓝色,可以用来检测假设3。
本题难度:一般