微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列属于强电解质的是
A.醋酸
B.酒精
C.铜
D.小苏打
参考答案:D
本题解析:试题分析:A项:醋酸是化合物,在水溶液中是部分电离的电解质,属于弱电解质,故错;
B项:酒精是化合物,但其水溶液只存在乙醇分子,不导电,属于非电解质,故错;
C项:金属铜是单质,它既不是电解质也不是非电解质,故错;
故错D。
考点:强电解质和弱电解质的概念
点评:本题是对基本概念强电解质的考查,题目难度不大,平时学习注意概念的辨析、基础知识的积累。
本题难度:困难
2、选择题 下列离子方程式正确的是?(?)
A.用醋酸除去水垢:

B.苯酚与碳酸钠反应: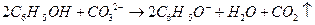
C.苯酚钠溶液中通入少量CO2: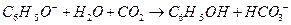
D.乙酸乙酯与氢氧化钠溶液反应:
参考答案:C
本题解析:A项,醋酸属于弱酸,不能拆成离子形式,正确写法是
 ;B项,苯酚属于弱酸,酸性弱于H2CO3,所以该反应不能发生;D项,正确写法是
;B项,苯酚属于弱酸,酸性弱于H2CO3,所以该反应不能发生;D项,正确写法是 。
。
本题难度:简单
3、选择题 下列说法正确的是
A.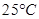 时
时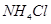 溶液的KW大于
溶液的KW大于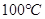 时
时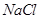 溶液的KW
溶液的KW
B.SO2通入碘水中,反应离子方程式为
C.加入铝粉能产生H2的溶液中,可能存在大量的
D.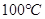 时,将pH=2的盐酸与pH=12的
时,将pH=2的盐酸与pH=12的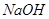 溶液等体积混合,溶液显中性
溶液等体积混合,溶液显中性
参考答案:C
本题解析:
正确答案:C
水的离子积常数只与温度有关,温度越高,Kw越大,A错;SO2通入碘水中生成SO42-,B错;加入铝粉能产生H2的溶液可能是强酸性溶液,也可能可能是强碱性溶液,在强酸性溶液中不可能存在AlO2―和NO3-,在强碱性溶液中,C中离子互不反应,可以大量共存,C正确;100℃时,Kw=1×10-12,所以将pH=2的盐酸与pH=12的NaOH溶液等体积混合后,溶液显碱性,D错;选C。
本题难度:一般
4、选择题 下列热化学方程式或离子方程式中,正确的是
A.将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-38.6kJ?mol-1
C.甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1
D.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2
参考答案:A
本题解析:分析:A.钠与水反应生成NaOH、氢气,遵循电子守恒、电荷守恒、质量守恒定律;
B.将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,但1molN2和3molH2置于密闭的容器中充分反应放热不是38.6kJ,该反应为可逆反应;
C.燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,气态水不是稳定状态;
D.氨水中一水合氨为弱电解质.
解答:A.将金属钠加入水中的离子反应为2Na+2H2O=2Na++2OH-+H2↑,遵循电子守恒、电荷守恒、质量守恒定律,故A正确;
B.因反应为可逆反应,则将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)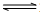 2NH3(g)△H>=-38.6kJ?mol-1,故B错误;
2NH3(g)△H>=-38.6kJ?mol-1,故B错误;
C.甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ?mol-1,故C错误;
D.氯化镁溶液与氨水反应的离子反应为Mg2++2NH3.H20=Mg(OH)2↓+2NH4+,故D错误;
故选A.
点评:本题考查离子反应方程式的书写、燃烧热、热化学反应方程式,熟悉发生的化学反应及相关概念是解答的关键,注意B为学生解答的难点和易错点.
本题难度:困难
5、选择题 只用试管和胶头滴管无法区分的一组溶液是
A.KOH和AlCl3
B.AlCl3和氨水
C.NaAlO2和盐酸
D.Na2CO3和盐酸
参考答案:B
本题解析:此类题型一般通过两物质间的互相滴加、依据现象的不同进行鉴别,AlCl3和氨水不论如何滴加现象相同(生成白色沉淀),故选B
本题难度:一般