微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子,在指定环境中一定能大量共存的是
A.加入金属镁能产生H2的溶液中:Na+、Fe3+、SO42-、NO3-
B.由水电离出的C(OH-)=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl-
C.C(OH-)=1×10-3mol/L的溶液中:K+、SO42-、Cl-、CO32-
D.能使pH试纸变深红色的溶液中:S2-、SO32-、Na+、SO42-
参考答案:C
本题解析:离子间如果发生化学反应,则不能大量共存,反之可以。加入金属镁能产生H2的溶液,说明溶液显酸性,在硝酸溶液中不可能生成氢气,A不能大量共存。B中说明该溶液中水的电离被抑制,溶液可能显酸性,也可能显碱性,如果显碱性,则Fe2+、NH4+不能大量共存。如果显酸性,则Fe2+、和ClO-会发生氧化还原反应,所以选项B中离子一定不能大量共存。C中溶液显碱性,可以大量共存。D中溶液显酸性,S2-、SO32-发生氧化还原反应,所处SO2和单质S,不能大量共存。答案选C。
本题难度:一般
2、选择题 现有如下几个离子方程式①CaCO3+2H+═Ca2++H2O+CO2↑②H++CO32-═HCO3- ③CO2+H2O+ClO-═HClO+HCO3-④CO32-+HSO3-═HCO3-+SO42-,由此得出的如下结论中不正确的是( )
A.CO32-与H+、Ca2+不能大量共存
B.H2CO3的酸性比HClO强,比H2SO3弱
C.H2SO3是一种强酸
D.H2CO3、HClO都属于弱酸
参考答案:A、CO32-与H+、Ca2+发生反应分别生成水、二氧化碳以及碳酸钙,不能大量共存,故A正确;
B、根据反应CO2+H2O+ClO-═HClO+HCO3-和强酸制弱酸的原理可以知道H2CO3的酸性比HClO强,比H2SO3弱,故B正确;
C、H2SO3是一种弱酸,故C错误;
D、碳酸和次氯酸均不能完全电离,都属于弱酸,故D正确.
故选C.
本题解析:
本题难度:简单
3、选择题 下列化学方程式书写正确,且能用离子方程式Ba2++CO32-=BaCO3↓表示的是
A.Ba(OH)2+CO2=BaCO3↓+H2O
B.Ba(HCO3)+Ba(OH)2 = 2BaCO3↓+2H2O
C.Ba(NO3)2+ Na2CO3= BaCO3↓+2NaNO3
D.Ba(OH)2+ 2KHCO3 = BaCO3↓+KOH+H2O
参考答案:C
本题解析:离子方程式分别为:Ba2++2OH—+CO2=BaCO3↓+H2O、Ba2++HCO3—+OH—= BaCO3↓+H2O、Ba2++CO32-=BaCO3↓、Ba2++2OH-+2HCO3—=BaCO3↓+2H2O+CO32-
本题难度:一般
4、选择题 下列四个反应可用H++OH-=H2O这个离子方程式表示的是(?)
A.Ba(OH)2溶液与稀硫酸
B.Cu(OH)2与稀硫酸
C.NaOH溶液与稀硫酸
D.NH3?H2O与稀硫酸
参考答案:C
本题解析:A不正确,因为反应中还有硫酸钡白色沉淀生成;B不正确,氢氧化铜是难溶性物质,应该用化学式表示;D不正确,氨水是弱碱,应该用化学式表示,因此正确的答案选C。
点评:该题是中等难度的试题,属于离子方程式的逆向判断,有利于培养学生的逻 辑推理能力和逆向思维能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
5、选择题 已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1mol/L的Fe(NO3)3和
Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积关系,合理的是
[? ]
A.
B.
C.
D.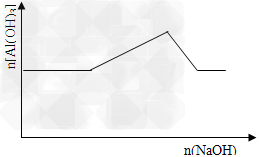
参考答案:C
本题解析:
本题难度:一般