微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能实现下列物质间直接转化的元素是( )
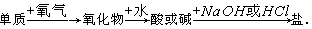
A.硅
B.硫
C.铜
D.铁
参考答案:B
本题解析:
本题难度:一般
2、简答题 如图是六种物质的相互转化关系.已知E是固态单质,常见于火山口处,六种物质中均含有构成E的元素.
(1)写出下列物质的化学式:A______;F______.
(2)请完成下列化学方程式:
反应①______;
反应④______;
C+D→E的反应______.

参考答案:E是固态单质,常见于火山口处,则E为硫单质,硫与氧气反应生成C,C与氧气反应生成F,则C为SO2、F为SO3.SO2与足量的NaOH溶液反应生成A为Na2SO3,SO3与水反应生成B为H2SO4.浓硫酸与Na2SO3、Cu都能反应生成C(SO2).D与氧气反应生成SO2,与SO2反应或加热条件下都能生成硫单质,则D为H2S,
(1)由上述分析可知,A为Na2SO3,F为,
故答案为:Na2SO3;SO3;
(2)反应①的方程式为:SO2+2NaOH═Na2SO3+H2O;
反应④的方程式为:Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O;
C+D→E的反应方程式为:SO2+2H2S═3S↓+2H2O,
故答案为:SO2+2NaOH═Na2SO3+H2O;Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O;SO2+2H2S═3S↓+2H2O.
本题解析:
本题难度:简单
3、推断题 已知A、B、C、D为常见单质,其中B、C、D常温常压下为气体,甲、乙、丙、丁为常见的化合物,乙常温下为液体,丙的焰色反应为黄色,下图为各种物质之间的转化关系。
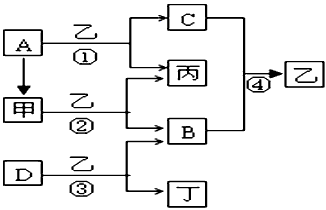
(1)写出下列物质的化学式:A__________,B__________,D__________。
(2)甲的电子式为__________,反应②中若有11.2L(标准状况下)B生成,则发生转移的电子的物质的量为__________。
(3)写出反应③的离子方程式:__________________________。
参考答案:(1)A: Na;B: O2;D: F2
(2)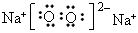 ;1mol
;1mol
(3)2F2+2H2O==4HF+O2
本题解析:
本题难度:一般
4、简答题 用下列装置进行以下实验:加热白色固体A(A灼烧时火焰为黄色)生成白色固体B,并放出气体C和D,气体D与淡黄色固体E反应,生成固体B和气体F.
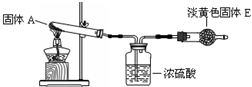
试回答下列问题:
(1)写出下列物质的化学式:
A______D______E______F______.
(2)写出下列反应的离子方程式:
①向B的稀溶液中通入D:______;
②向A的溶液中滴加氢氧化钠溶液:______.
参考答案:加热白色固体A(A灼烧时火焰为黄色)生成白色固体B,并放出气体C和D,则A、B含有Na元素,气体D与淡黄色固体E反应,生成固体B和气体F,应是Na2O2与CO2反应生成Na2CO3与O2,可推知D为CO2,E为Na2O2,B为Na2CO3,F为O2,故A为NaHCO3,C为水蒸气,
(1)由上述分析可知,A为NaHCO3,D为CO2,E为Na2O2,F为O2,
故答案为:NaHCO3;CO2;Na2O2;O2;
(2)①向Na2CO3的稀溶液中通入CO2,反应生成碳酸氢钠,反应离子方程式为:CO32-+CO2+H2O=2HCO3-,
故答案为:CO32-+CO2+H2O=2HCO3-;
②向NaHCO3的溶液中滴加氢氧化钠溶液,反应生成碳酸钠与水,反应离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O.
本题解析:
本题难度:一般
5、填空题 下图是中学化学某些物质之间在一定条件下的相互转化关系,已知A是一种常见的液态化合物,C、D、G、H、K是单质,其它为化合物,G、K是普通钢中的两种重要元素,其中K含量少,E、F对应溶液的酸碱性相反,F的焰色反应为黄色,请按要求作答:
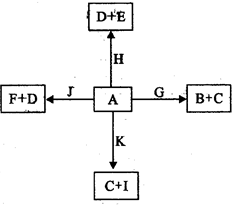
(1)写出化合物的电子式:_________________________。
(2)①写出A与J反应的离子方程式:_______________________________________。
②将少量的H通入F的溶液中,反应的总离子方程式为:_________________________。
(3)B与足量稀硝酸反应,当参加反应的硝酸为4mol,转移电子的物质的量为_________mol(保留2位有效数字)。
(4)已知在200℃,101Kpa下,0.12g单质K与A完全反应生成C与I,吸收了1316J的能量,写出此反应的热化学方程式:_________________________________________。
(5)①以Pt为电极,由I、D以及F的溶液组成原电池,则正极的电极反应为:___________。
②若用此电池电解300mL5mol/L的氯化钠溶液一段时间,两极均收集到标准状况下3.36L气体,此时溶液的pH为_________(假设电解前后溶液体积不变化)。
③若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),此时溶液中所有离子浓度的关系由大到小的顺序为:_______________________________________。
参考答案:(1)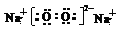 ?
?
(2) ①2H2O+2Na2O2=" 4" Na++4OH-+ O2↑?②2F2+4 OH-= 4F-+ O2+2H2O
(3)0.43
(4)C(s)+H2O(g)=CO(g)+H2(g)?H=+131.6kJ/mol(条件2000C,101Kpa不注明扣一分,状态标错不给分,+漏掉不给分)(2分)?
(5)①O2+4e-+2H2O = 4OH-?(2分)
②14?(2分)?
③c(Na+)>c(Cl-)>c(HCO3—) >c(CO32—)>c(OH-)>c(H+) (2分) (漏写离子不给分)
本题解析:依题意可以推出A+H的反应为2F2+2H2O=4HF+O2,A+G的反应为3Fe+4 H2O=Fe3O4 +4H2, A+K的反应为C+ H2O="CO" + H2.A+J的反应为2Na2O2 +2H2O="4NaOH+" O2,可以完整回答出(1)(2)两问。(3)Fe3O4与HNO3反应时转移的电子数为4*(1/28)*3=0.43mol.(4) C(s)+H2O(g)=CO(g)+H2(g)?H="+131.6kJ/mol(5)" ①O2作正极,O2+4e-+2H2O = 4OH-②2NaCl + 2H2O ="2NaOH" + H2 + Cl2 .通过两极产生气体的体积为3.36L可以算出NaOH的物质的量0.3mol,进而求出NaOH的浓度为1mol/L,pH="14." ③通入4.48L二氧化碳后溶液中有1.2molNaCl,Na2CO3为0.1mol ,NaHCO3为0.1mol。考虑CO32-水解能力大于HCO3-,可以推出各离子的浓度大小关系。
本题难度:困难