微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)已知A、B、C、D为气体,E、F为固体,G为CaCl2,它们之间的转化关系如下:
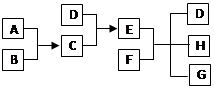
(1)D的结构式为?, E的电子式为?。
(2)用电子式表示A和B反应形成C的过程?。
(3)E和F反应生成D、H和G的化学方程式?,该反应的用途是?。
参考答案:(1)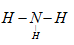 、
、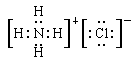
(2)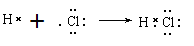
(3)2NH4Cl+Ca(OH)2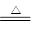 CaCl2+2H2O+2NH3↑?实验室制氨气
CaCl2+2H2O+2NH3↑?实验室制氨气
本题解析:两种固体反应生成气体和氯化钙的反应最常见的应是实验室制取氨气的方程式。即D是氨气,氨气和氯化物反应生成氯化铵,即C是氯化氢,E是氯化铵,F是氢氧化钙。A、B是氢气和氯气。
本题难度:一般
2、填空题 A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙存在如图所示的转化关系(转化过程都不需要使用催化剂).
完成下列问题:

(1)若甲是常见金属,乙是常见非金属固体单质,A、C在常温下均为无色气体,且A、B、C、甲、乙、丙都由短周期元素组成,则B的电子式是______.A与甲反应的化学方程式是______.
(2)若上图所示的反应在水溶液中进行,甲在常温下为有色气体,乙在常温下为液体,丙是生活中常见的金属,则:
①丙与C反应的离子方程式为______.
②往A溶液中逐滴加入NaOH溶液时可能出现的现象是______.
参考答案:由框图可知化合物A+单质甲化合物B+单质乙为置换反应,甲为金属,A为无色气体且组成化合物A的一种元素为可变价态,所以推断甲为Mg,A为CO2;若在溶液中发生,丙为变价金属,可以推出丙可能是Fe,甲为有色气体,甲为Cl2,可采取带入法检验.单质乙在常温下是液体,所以乙一定是液溴.
(1)若甲是常见金属,乙是常见非金属固体单质,A、C在常温下均为无色气体,且A、B、C、甲、乙、丙都由短周期元素组成,推断出甲为Mg;乙为C;丙为O2;A为CO2;B为MgO,C为CO;B的电子式为:
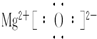
,A与甲反应的化学方程式是2Mg+CO2?点燃?.?2MgO+C,
故答案为:
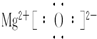
;2Mg+CO2?点燃?.?2MgO+C;
(2)若上图所示的反应在水溶液中进行,甲在常温下为有色气体,乙在常温下为液体,丙是生活中常见的金属,则甲为Cl2;单质乙为Br2;丙为Fe;A为FeBr2;B为FeCl3;C为FeBr3;
①丙Fe与CFeBr3反应的离子方程式为Fe+2Fe3+═3Fe2+,故答案为:Fe+2Fe3+═3Fe2+;
②往A(FeBr2)溶液中逐滴加入NaOH溶液时可能出现的现象是生成白色沉淀,迅速变成灰绿色,最后变成红褐色,故答案为:生成白色沉淀,迅速变成灰绿色,最后变成红褐色.
本题解析:
本题难度:一般
3、填空题 (8分)A、B、C、D、E、F六种物质的相互转化关系如右图所示。图中反应条件均未标出,部分产物(包括水)已略去,反应①是置换反应。
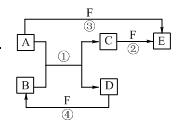
(1)若B、C、F都是气态单质,且B为黄绿色有毒气体。③和④两个反应中都有水生成,反应②需要放电才能发生。A、D均为极易溶于水的气态氢化物,且相遇有白烟生成。则A分子的立体构型为?,反应③的化学方程式为 ?。
?。
(2)若A、D为短周期元素的单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍。F是一种含氧酸,③和④两个反应中都有红棕色气体生成。则E的化学式为
? ?
? ?,反应④的化学方程式为?。
?,反应④的化学方程式为?。
参考答案:(1)三角锥形(2分);?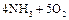

 (2分)
(2分)
(2)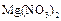 (2分);?
(2分);?

 ?(2分)
?(2分)
本题解析:略
本题难度:一般
4、简答题 A是一种红棕色金属氧化物,B、D是金属单质,C也是一种金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体,受热后容易发生分解.

(1)写出下列物质的化学式:A:______,J:______.
(2)按要求写方程式:
A与B在高温条件下生成C和D的化学方程式:______;C转化为I的离子方程式:______.在E的水溶液中通入氯气的离子方程式:______.
参考答案:A是一种红棕色金属氧化物,则A是Fe2O3,G是红褐色沉淀,分解生成氧化铁,则G是 Fe(OH)3,F是 Fe(OH)2.B、D是金属单质,Fe2O3和B在高温下能反应生成金属单质D,则该反应是铝热反应,B是Al,D是Fe,C是Al2O3,J是一种不溶于水的白色化合物,受热容易分解成C,则J是Al(OH)3,由转化关系可知,I是NaAlO2,H是AlCl3;铁和盐酸反应生成氯化亚铁和氢气,E和氨水反应生成 Fe(OH)2,则E是 FeCl2,
(1)通过以上分析知,A为Fe2O3、J为Al(OH)3,
故答案为:Fe2O3;Al(OH)3;
(2)A与B在高温条件下生成C和D的反应为铝热反应,反应的方程式为Fe2O3+2Al高温.Al2O3+2Fe,
铝与氢氧化钠溶液反应可生成偏铝酸钠和氢气,反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O,
氯气和氯化亚铁反应生成氯化铁,反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-,
故答案为:Fe2O3+2Al高温.Al2O3+2Fe;Al2O3+2OH-═2AlO2-+H2O;Cl2+2Fe2+=2Fe3++2Cl-.
本题解析:
本题难度:一般
5、填空题 (12分)2011年8月云南报道铬渣污染事件,铬渣中到含璃+6价的铬而使其毒性强利用钛铁矿(TiO2、FeO、Fe2O3)生产钛白粉的副产品(硫酸亚铁),可以把其还原为+3价的铬,在碱性条什生成氢氧化铬沉淀。
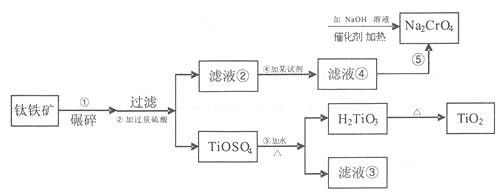
(1)碾碎的目的是?
(2)加入过量的硫酸除让铁矿充分反应外,还起到的作用是? [来
(3)第④步所加试剂是?
(4)上述物质中可循环使用的试剂是(写化学式)?
(5)写出滤液④与Na2CrO4在NaOH溶液中反应的离子反应方程式?
(6)第③步中加热的目的是?
参考答案:增大接触面积,加快反应速率(2分)
(2)抑制Fe3+、Fe2+的水解,有利于钛从溶液中分离(2分)
(3)铁粉(2分)(4)H2SO4,(2分)
(5)CrO42-+3 Fe2++4OH-+4H2O=Cr(OH)3↓+3Fe(OH)3↓(2分)
(6)促进TiOSO4水解(2分)
本题解析:矿石碾碎的目的是增大接触面积,加快反应速率;加入过量的硫酸除让铁矿石充分反
应外,还起到的作用是抑制Fe3+、Fe2+的水解,而使钛变为TiOSO4使之与铁分离;第④步
所加试剂是铁粉,将过量的硫酸反应及将Fe3+还原为Fe2+,并在第⑤步Fe2+将Na2CrO4还原:
CrO42-+3 Fe2++4OH-+4H2O=Cr(OH)3↓+3Fe(OH)3↓;第③步中加热的目的是促进TiOSO4水解,
生成的硫酸可循环利用
本题难度:一般