正反应速率加快,逆反应速率不变
参考答案:AC
本题解析:
正确答案AC
A、当其他条件不变时,增大反应物浓度化学反应速率加快。
B、在化学反应前后,催化剂的质量和化学性质都没有发生改变,但物理性质改变,催化剂可能参加反应。
C、NH4Cl晶体与Ba(OH)2.8H2O晶体为吸热反应。
D、H2(g)+ I2(g)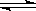 2HI(g),把容积缩小一倍,浓度均增大,正逆反应速率均加快,只是变化的幅度相同,所以平衡不移动。 2HI(g),把容积缩小一倍,浓度均增大,正逆反应速率均加快,只是变化的幅度相同,所以平衡不移动。
本题难度:一般
2、选择题 已知3克乙烷在常温下完全燃烧放出的热量是155.98kJ,则下列乙烷燃烧热的热化学方程式书写正确的是(?)
A.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H ="-2119.6" kJ/mol
B.C2H6(g)+5/2O2(g)=2CO2(g)+3H2O(g)△H ="-1559.8kJ/mol"
C.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(g)△H ="-1559.8" kJ/mol
D.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l)△H ="-1559.8" kJ/mol
参考答案:D
本题解析:由题目所给信息可折算出1mol乙烷完全燃烧时所放出的热量为1559.8 kJ,再结合燃烧热的概念(1mol可燃物完全燃烧生成稳定的氧化物所放出的热量),则答案为D
本题难度:一般
3、选择题 下列反应中,属于吸热反应的是
A.活泼金属跟酸反应
B.制造水煤气
C.酸碱中和反应
D.镁条燃烧
参考答案:B
本题解析:A、活泼金属跟酸反应,C、酸碱中和反应,D、镁条燃烧这三种反应的热效应都是放热反应。
本题难度:一般
4、选择题 用50 mL 0.55 mol/L盐酸与50 mL 0.50 mol/L NaOH溶液进行中和热测定的实验,测量结果偏高的原因可能是( )
A.实验装置保温、隔热效果差
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
参考答案:C
本题解析:中和热的测定过程中,A项实验装置保温、隔热效果差,损失热量,测量结果会偏低;B项用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,会造成粘在温度计上的氢氧化钠与盐酸反应,导致反应放出的热量偏低;C项量取NaOH溶液的体积时仰视读数,会使实际的氢氧化钠体积大于50mL,结果放出热量偏多,导致结果偏大;D项分多次把NaOH溶液倒入盛有盐酸的小烧杯中,反应过慢,导致损失的热量多,测定结果偏低。
点评:对于中和热测定的原理、装置、步骤要清楚,本题难度不大。
本题难度:一般
5、选择题 下列关于热化学反应的描述中正确的是? ( )
A.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+ O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=571.6 kJ·mol-1
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
参考答案:D
本题解析:A、中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量,生成2molH2O所放出的热量为2×57.3kJ,但生成硫酸钡沉淀的反应还要吸收热量,则H2SO4和Ba(OH)2反应的反应热小于2×(-57.3)kJ?mol-1,故A错误;B、由燃烧热的概念可知,甲醇燃烧应生成液态水,则CH3OH的燃烧热一定不为192.9kJ?mol-1,故B错误;C、H2(g)的燃烧热是285.8kJ?mol-1,生成液态水,则2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ?mol-1,故C错误;D、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,葡萄糖的燃烧热是2800kJ?mol-1,则 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1400kJ?mol-1,故D正确;故选D。 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1400kJ?mol-1,故D正确;故选D。
本题难度:一般
|