微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 科学家指出,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价砷类化合物.下列说法不正确的是( )
A.维生素C具有还原性
B.上述过程中砷元素发生还原反应
C.因为虾类等水生甲壳类动物中含有砷元素,所以不能食用
D.+5价砷转化为+3价砷时,失去电子
参考答案:A、食用虾类等水生甲壳类动物中含有+5价砷类物质,与维生素C反应生成+3价砷类化合物,则维生素C具有还原性,故A正确;
B、上述过程中砷元素化合价降低,发生还原反应,故B正确;
C、虾类等水生甲壳类动物中含有+5价砷类物质,无毒,但+3价砷类化合物有毒,故C错误;
D、+5价砷转化为+3价砷时,化合价降低,得到电子,故D错误.
故选CD.
本题解析:
本题难度:一般
2、填空题 在反应S+2KNO3+3C=K2S+N2↑+3CO2↑中,______元素被氧化,______元素被还原;______?元素的原子得到电子,______?元素的原子失去电子;______是氧化剂,______是还原剂;______是氧化产物,______是还原产物.
参考答案:S+2KNO3+3C=K2S+N2↑+3CO2↑中,S元素的化合价0→-2价,N元素的化合价由+5价→0价,C元素的化合价由0价→+4价,所以被氧化的元素是C,被还原的元素是S、N;
S、N元素的原子得电子化合价降低,C元素的原子失电子化合价升高;
得电子化合价降低的反应物是S、KNO3,作氧化剂,失电子化合价升高的反应物是C,作还原剂;
氧化产物是CO2,还原产物是K2S、N2,
故答案为:C;S、N;S、N;C;S、KNO3;C;CO2;K2S、N2.
本题解析:
本题难度:一般
3、填空题 3H2O2+2H2CrO4═2Cr(OH)3+3O2↑+2H2O
(1)其中Cr被______,H2O2作______剂.
(2)反应转移了0.3mol电子,则产生的气体在标准状态下体积约为______.
参考答案:(1)3H2O2+2H2CrO4═2Cr(OH)3+3O2↑+2H2O,反应中氧元素化合价-1价变化为0价,元素化合价升高做还原剂被氧化发生氧化反应;铬元素化合价从-6价变化为+3价,元素化合价降低做氧化剂被还原发生还原反应,
故答案为:还原;还原;
(2)3H2O2+2H2CrO4═2Cr(OH)3+3O2↑+2H2O依据元素化合价变化生成3mol氧气转移电子6mol,反应转移了0.3mol电子,则产生的气体0.15mol,在标准状态下体积约为0.15×22.4L/mol=3.36L,故答案为:3.36L.
本题解析:
本题难度:一般
4、简答题 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和.甲、乙组成的成见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.
请回答下列问题:
(1)戊离子的结构示意图为______.
(2)写出乙的单质的电子式:______.
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为______.
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:______.
(5)按右图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:______.将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是______.
参考答案:甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝,则X是NH3,甲是H,乙是N,甲、丙处于同一主族,并且丙的原子序数大于N,则丙是Na.根据戊原子的最外层电子数是甲、乙、丙原子的最外层电子数之和,则戊原子最外层电子数=1+1+5=7,则戊是Cl,戊的单质是Cl2,与NH3反应生成乙的单质N2和NH4Cl、HCl;并且0.1?mol?L-1的Y溶液的pH>1,则Y是NH4Cl,
Z是HCl,丁的单质能与NaOH溶液反应,也能与HCl水溶液反应,则丁是Na,生成的盐L是NaAlO2,丙、戊组成的化合物M为NaCl;
(1)Cl-的结构示意图为:
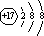
,故答案为:
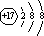
;
(2)乙单质N2中含有共价三键,电子式为:
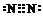
,故答案为:
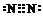
;
(3)NH3与Cl2反应的化学方程式:4NH3+3Cl2═N2+2NH4Cl+4HCl,在反应中氨气做还原剂,氯气做氧化剂,被氧化的物质氨气只占反应掉的一半,被氧化的物质氨气与被还原的物质氯气物质的量之比为:2:3,故答案为:2:3.
(4)将少量的盐酸滴入过量NaAlO2溶液中发生反应的离子方程式为:AlO2-+H++H2O═Al(OH)3↓,故答案为:AlO2-+H++H2O═Al(OH)3↓;
(5)电解饱和氯化钠溶液,反应的方程式为:2NaCl+2H2O?电解?.?2NaOH+Cl2↑+H2↑,电解后得到NaOH溶液,显碱性,滴入酚酞溶液中,观察到溶液变红,故答案为:酚酞溶液溶液变红.
本题解析:
本题难度:一般
5、选择题 制备单质硅的主要化学反应如下:
①SiO2+2C
Si+2CO↑?②Si+2Cl2SiCl4?③SiCl4+2H2Si+4HCl
下列对上述三个反应的叙述中,错误的是( )
A.①③为置换反应
B.①②③均为氧化还原反应
C.三个反应的反应物中硅元素均被氧化
D.①、③中的C和H2均为还原剂
参考答案:A、①SiO2+2C?高温?.?Si+2CO↑;③SiCl4+2H2?高温?.?Si+4HCl;反应符合置换反应的概念,故A正确;
B、①SiO2+2C?高温?.?Si+2CO↑,反应前后有元素化合价变化;?②Si+2Cl2?高温?.?SiCl4?反应前后有化合价变化;?③SiCl4+2H2?高温?.?Si+4HCl,反应前后有元素化合价变化;故B正确;
C、①SiO2+2C?高温?.?Si+2CO↑反应前后硅元素化合价降低被还原;?②Si+2Cl2?高温?.?SiCl4?反应前后硅元素化合价升高,被氧化;?③SiCl4+2H2?高温?.?Si+4HCl,反应前后硅元素化合价降低,被还原;故C错误;
D、①SiO2+2C?高温?.?Si+2CO↑,反应中碳化合价升高座还原剂;③SiCl4+2H2?高温?.?Si+4HCl,反应中氢气中氢元素化合价升高做还原剂.故D正确;
故选C.
本题解析:
本题难度:简单