微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知氢化锂(LiH)属于离子化合物.LiH跟水反应可以放出氢气.下列叙述中正确的是( )
A.LiH的水溶液显中性
B.LiH中的氢离子可以被还原生成氢气
C.LiH是一种强氧化剂
D.LiH中氢离子比锂离子的半径大
参考答案:A、LiH跟水反应的方程式为LiH+H2O=H2↑+LiOH,溶液呈碱性,故A错误;
B、在离子化合物LiH中,Li+与H-以离子键结合而成,H-与水中的H+之间发生氧化还原反应而被氧化,故B错误;
C、LiH+H2O=H2↑+LiOH反应中,LiH是还原剂,H2O是氧化剂,故C错误;
D、LiH中氢离子与锂离子核外电子排布相同,核电核数越小,半径越大,则LiH中氢离子比锂离子的半径大,故D正确.
故选D.
本题解析:
本题难度:一般
2、简答题 (1)已知离子反应:RO3n-+6I-+6H+=R-+3I2+3H2O,n=______,R元素在RO3n-中的化合价是______.
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质.例如:
①在上述有编号的步骤中,需用氧化剂的是______(填编号).
②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
______Na2Cr2O7+______KI+______HCl--______CrCl3+_NaCl+______KCl+______I2+

(用单线桥表示电子转移的方向、数目)当反应中有3mol电子转移时,氧化产物的质量是______.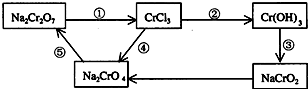
参考答案:(1)根据电荷守恒可得n=1,RO3-中氧元素的化合价是-2价,根据化合价规则,所以R的化合价是+5,
故答案为:1;+5;
(2)①合价升高元素在反应中被氧化,需加入氧化剂才能实现,在各步转化中,只有④是化合价的升高的转化,所以④的转化需加入氧化剂才能实现,
故答案为:④;
②在反应中,化合价升高的元素是碘元素,从-1价升高到0价,两碘元素共升高2价,化合价降低元素是铬元素,化合价从+6价降到+3价,两铬元素共降低6价,根据得失电子守恒,所以反应转移的电子数为6,电子转移的方向和数目为:
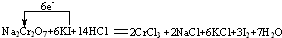
,化合价升高的元素对应的产物单质碘是氧化产物,转移6mol电子时,生成单质碘3mol,当转移3mol电子时,则生成碘单质1.5mol,质量是:1.5ml×254g/mol=381g,
故答案为:
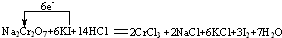
,381g.
本题解析:
本题难度:一般
3、选择题 人体正常的血红蛋白中含有亚铁离子,若误食亚硝酸盐,则使血红蛋白中亚铁离子转化为铁离子而丧失其生理功能,临床证明服用维生素C可以解毒,这说明维生素C具有( )
A.酸性
B.碱性
C.氧化性
D.还原性
参考答案:用维生素C可以缓解亚硝酸盐中毒,维生素C可以把Fe3+离子还原成Fe2+离子,这说明维生素C具有还原性.
故选D.
本题解析:
本题难度:简单
4、简答题 (1)铁元素在人体中是以离子形式存在的,人体中经常进行的相互转化,

在A过程中,Fe2+做______剂,在B过程中,Fe3+体现______性;“如果服用维生素C,可使食物中三价铁离子转化成二价铁离子.“这句话指出,维生素C在这一反应中做______剂,具有______性.
(2)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向0.2mol/L?1L?FeBr2溶液中通入标准状况下氯气2.24L,被氧化的微粒是______,此反应的离子方程式:______.
参考答案:(1)在A过程中,亚铁离子化合价从+2价升高到了+3价,化合价升高元素所在的反应物是还原剂,具有还原性,服用维生素C,可使食物中三价铁离子转化成二价铁离子,说明维生素C能使铁元素化合价降低,所以维生素C是还原剂,具有还原性,故答案为:还原,氧化,还原,还原;
(2)还原性Fe2+>Br-,向0.2mol/L1L?FeBr2溶液中通入标准状况下氯气2.24L(即0.1mol)时,氯气先将亚铁离子氧化,如果氯气剩余再氧化溴离子,而0.1mol氯气只能和0.2mol的亚铁离子恰好反应,所以被氧化的微粒是只有亚铁离子,即2Fe2++Cl2=2Fe3++2Cl-,故答案为:Fe2+,2Fe2++Cl2=2Fe3++2Cl-.
本题解析:
本题难度:一般
5、选择题 下列反应中,水作还原剂的是( )
A.CO2+H2O=H2CO3
B.Na2O+H2O=2NaOH
C.2F2+2H2O=4HF+O2
D.2Na+2H2O=2NaOH+H2↑
参考答案:A.CO2+H2O═H2CO3中,各元素的化合价没有变化,则不属于氧化还原反应,水为反应物,故A不选;
B.该反应中,各元素的化合价没有变化,则不属于氧化还原反应,水为反应物,故B不选;
C.2F2+2H2O═4HF+O2中,水中O元素的化合价升高,则水作还原剂,故C选;
D.2Na+2H2O═2NaOH+H2↑中,水中H元素的化合价降低,则水为氧化剂,故D不选;
故选C.
本题解析:
本题难度:简单