微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,______是氧化剂,______元素被氧化,氧化产物是______,此反应中,HCl表现的性质有______性和______性.
参考答案:在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,Mn元素化合价降低,所以KMnO4 是氧化剂,
HCl中Cl元素化合价升高,反应物HCl是还原剂,具有还原性,Cl元素被氧化,对应产物Cl2是氧化产物,
盐酸中的Cl有部分转化为化合价不变的氯化钾中去,也体现了盐酸的酸性,
故答案为:KMnO4 ;Cl(或氯);Cl2;酸;还原.
本题解析:
本题难度:简单
2、选择题 下列反应中,氧化剂与还原剂的物质的量之比为1:2的是( )
①O3+2KI+H2O═2KOH+I2+O2 ②SiO2+2C
Si+2CO↑?③SiO2+3CSiC+2CO↑ ④4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O.
A.仅有②
B.仅有②④
C.①②③④
D.仅有②③④
参考答案:①O3+2KI+H2O═2KOH+I2+O2反应中O3中的氧元素化合价降低,碘元素的化合价升高,则O3为氧化剂,KI为还原剂,其物质的量之比为1:2;
②SiO2+2C?高温?.?Si+2CO↑中硅元素的化合价降低,碳元素的化合价升高,则SiO2为氧化剂,C为还原剂,其物质的量之比为1:2;
③SiO2+3C?高温?.?SiC+2CO↑中碳元素的化合价既升高又降低,碳既是氧化剂又是还原剂,且1个碳原子化合价降低,2个碳原子的化合价升高,即氧化剂与还原剂的物质的量之比为1:2;
④4HCl(浓)+MnO2?△?.?MnCl2+Cl2↑+2H2O中Mn元素的化合价降低,氯元素的化合价升高,则MnO2为氧化剂,HCl为还原剂,由反应可知,HCl有一半作还原剂,即氧化剂与还原剂的物质的量之比为1:2;
显然①②③④均符合题意,故选C.
本题解析:
本题难度:简单
3、选择题 下列单、双线桥的表示方法不正确的是( )
A.

B.
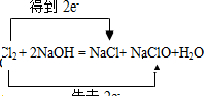
C.

D.
参考答案:A、钠元素的化合价升高,氯元素的化合价降低,则钠失去电子,转移的电子数为2e-,故A正确;
B、该反应中Cl元素的化合价既升高又降低,转移的电子数为e-,正确的表示为
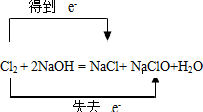
,故B错误;
C、该反应中钠失去电子,氢得到电子,转移的电子数为2e-,故C正确;
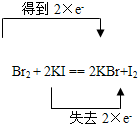
D、该反应中碘失去电子,溴得到电子,转移的电子数为2e-,故D正确;
故选B.
本题解析:
本题难度:简单
4、选择题 下列有关氧化还原反应的说法正确的是( )
A.浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂
B.工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化
C.在任何条件下都不能发生反应:Cu+H2 SO4=CuSO4+H2↑
D.亚氯酸可发生分解反应:HClO2→ClO2↑+Cl2+H2O(未配平),1?mol?HClO2分解时,转移电子的物质的量为1?mol
参考答案:A.盐酸与活泼金属反应得电子作氧化剂,与MnO2反应失电子作还原剂,故A正确;
B.SiO2+2C?高温?.?Si+2CO中,二氧化硅得电子被还原,故B错误;
C.以Cu为阳极,稀硫酸为电解质,可以构成电解池发生上述反应,故C错误;
D.根据得失电子相等配平该反应方程式为:8HClO2=6ClO2↑+Cl2+4H2O,每8mol亚氯酸分解转移电子的物质的量是6mol电子,所以 1mol HClO2分解时,转移电子的物质的量为0.75mol电子,故D错误;
故选A.
本题解析:
本题难度:简单
5、填空题 火药是中国的“四大发明”之一.黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S=K2S+N2↑+3CO2↑.其中被还原的元素是______,氧化剂是______,还原产物是______.
参考答案:反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,化合价降低的元素是S、N,两元素被还原,所以KNO3和S是氧化剂,还原产物是K2S和N2,故答案为:硫、氮;S、KNO3;S.
本题解析:
本题难度:一般