微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g) + B(g) ===?2C(g)反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol。则下列说法正确的是(?)
A.该时间段C的化学反应速率为0.2mol/(L·s)?
B.该时间段A的化学反应速率为0.125mol/(L·s)
C.该时间段B的化学反应速率为0.05mol/(L·s)?
D.到4s末时,B的转化率为20%?
参考答案:D
本题解析:解:4A(g) ?+?B(g)?===?2C(g)
起始? x? y? 0
变化? x- 0.5mol? y- 0.4mol? 0.2mol
4s末?0.5mol? 0.4mol? 0.2mol
化学计量数之比=变化物质的量之比
( x- 0.5mol?):(y- 0.4mol):0.2mol =4:1:2
得x=0.9? y=0.5
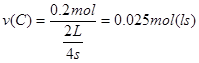 ,根据化学计量数之比=反应速率之比
,根据化学计量数之比=反应速率之比
得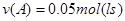 ?
?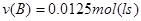
到4s末时,B的转化率
综上所述正确选项为D;
本题难度:简单
2、选择题 下列说法正确的是:(?)
A.仅含有Na+、H+、OH—、CH3COO—四种离子的某溶液中可能存在:
c(Na+)>c(OH—)>c(CH3COO—)>c(H+)
B.铝热法炼铁过程中镁条和氯酸钾起催化作用
C.二氧化硫的催化氧化是放热反应,升高温度可以减慢该反应的速率
D.人体内淀粉、脂肪、蛋白质的水解都是由酶所催化的
参考答案:AD
本题解析:略
本题难度:简单
3、选择题 现有反应4NH3+5O2=4NO+6H2O,反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)、表示,其关系正确的是( )
A.4v(NH3)=5(O2)
B.4v(NH3)=5v(H2O)
C.4(O2)=5v(NO)
D.4v(NH3)=5v(NO)
参考答案:已知4NH3+5O2?4NO+6H2O,由化学反应速率之比等于其化学计量数之比,则:
A.5v(NH3)=4v(O2),故A错误;
B.6v(NH3)=4v(H2O),故B错误;
C.4v(O2)=5v(NO),故C正确;
D.v(NH3)=v(NO),故D错误;
故选C.
本题解析:
本题难度:简单
4、填空题 (12分)化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g)  2CO(g)平衡常数K的表达式为 ;
2CO(g)平衡常数K的表达式为 ;
已知C(s) + H2O(g) CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)  CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为 。
CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为 。
(2)已知某温度下,反应2SO2+O2 2SO3,的平衡常数K=19
2SO3,的平衡常数K=19
在该温度下的体积固定的密闭容器中,c0(SO2)=1mol·L-1,c0(O2)="1" mol·L-1,当反应在该温度 下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行。
下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g)  cC(g)+dD(g) △H = a kJ·mol-1;若a+b>c+d,增大压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
cC(g)+dD(g) △H = a kJ·mol-1;若a+b>c+d,增大压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
参考答案:

本题解析:略
本题难度:一般
5、选择题 下列说法正确的是
A.增大压强,使单位体积内活化分子数目增加,化学反应速率一定增大
B.升高温度,使活化分子百分数增加,化学反应速率一定增大
C.活化分子间所发生的分子间的碰撞均为有效碰撞
D.加入反应物,使活化分子百分数增加,化学反应速率一定增大