| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《化学反应速率》高频试题巩固(2017年最新版)(八)
参考答案:D 本题解析:A、将Al粉改为Al片,Al的表面积减小,反应速率减小,错误;B、加入少量醋酸钠粉末,与HCl反应生成CH3COOH,CH3COOH是弱酸,反应速率减小,错误;C、水为纯液体,增加水的用量,反应速率不变,错误;D、提高反应温度,反应速率加快,正确。 本题难度:一般 3、填空题 (12分)控制变量法是研究化学变化规侓的重要思想方法。请仔细观察下表中50 mL稀盐酸和1g碳酸钙反应的实验数据:
(1)本反应属于________反应(填“吸热”或“放热”),反应的离子方程式为?。 (2)实验6和7表明,_________对反应速率有影响,_________反应速率越快,能表明同一规律的实验还有_________(填实验序号)。 (3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是?。 (4)本实验中影响反应速率的其它因素还有__________,能表明这一规律的实验序号是1、2与_______。 参考答案:(共12分) 本题解析:对比反映前后可以看到反应放热反应反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O。 本题难度:一般 4、选择题 反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是( ) 参考答案:由半分钟后,NO的物质的量增加了0.3mol,则用NO表示的化学反应速率为 本题解析: 本题难度:一般 5、简答题 合成氨反应过程中的能量变化如图所示,据图回答下列问题:
A.c1<c2?B.2c1<c3?C.a1+a2=1?D.?a2<a3. 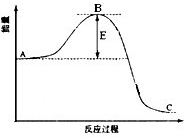 参考答案:(1)催化剂是通过降低反应的活化能来加快化学反应速率的,所以加活性铁会使图中B点降低,故答案为:降低;因为催化剂改变了反应的历程使活化能E降低; 本题解析: 本题难度:一般 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《氧化还原反.. | |