微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 锂离子电池的广泛应用使同收利用锂资源成为重要课题,某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源叫收研究,设计实验流程如下:
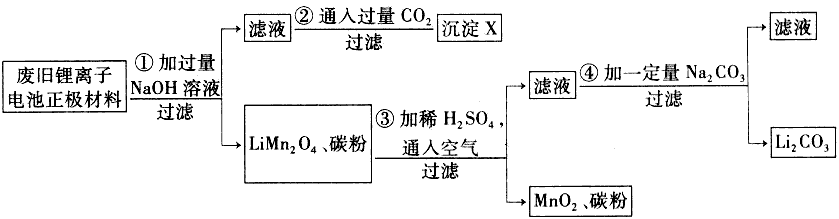
(1)第②步反应得到的沉淀X的化学式为________。
(2)第③步反应的离子方程式是______________________。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有_______________。 若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:__________________、________________。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0 mL 3.0 moI·L-1的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有_______g Na2CO3参加反应。
2、填空题 2012年冬天,我国城市空气污染状况受到人们的强烈关注。在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标。为了测定空气中的SO2含量,有三位同学分别采用了以下测定方法。
I.氧化还原法:甲同学拟采用下图所示的装置进行实验:
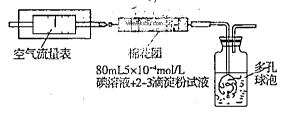
(1)该实验需要80mL5×10-4mol/L的碘溶液,甲同学应称量I2?g(精确到0.001),选择_______mL的容量瓶进行配制。该实验所涉及的氧化还原反应原理为?(用化学方程式表示),该实验原理是利用了SO2的?性。
(2)在甲同学所配碘溶液浓度准确,并且量取药品及实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因?.
Ⅱ.重量法:乙同学拟用右图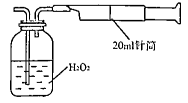 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
(3)取样处空气中SO2含量为?mg/L(精确到0.001)。
(4)已知,常温下BaSO3的KSP为5.48×10-7饱和亚硫酸溶液中c(SO2-3)=6.3×10-8mol/L。有同学认为以上实验不必用H?2O2吸收SO2,直接用0.1mol/L BaCl2溶液来吸收SO2即可产生沉淀,请用以上数据分析这样做是否可行?.
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的。该电池总的化学反应原理为:2SO2+O2+2H2O=2H2SO4
(5)请写出该电池负极的电极反应式?。
3、实验题 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_______________________________;
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。若有6mol的HCl参加反应,则转移的电子总数为_______________________;
MnCl2+Cl2↑+2H2O。若有6mol的HCl参加反应,则转移的电子总数为_______________________;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:_________________________,D:________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:___________________,
D:______________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________________________。
4、实验题 (15分)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究。
[实验一]取样品0.100 g,用右图所示实验装置进行测定。(夹持装置省略)
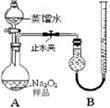
(1)检查装置A气密性的方法是 。
(2)若在实验过程中共产生气体11.20 mL(已折算成标准状况),则样品中Na2O2的纯度为 。
[实验二]样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并稀释至250 mL,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到 。
(4)取上述所配溶液各25.00 mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
实验次数
| 第一次
| 第二次
| 第三次
| 第四次
|
标准盐酸体积(mL)
| 23.00
| 24.98
| 25.00
| 25.02
|
由表中数据可知,标准盐酸体积的平均值为 mL。若滴定前用上述所配溶液润洗锥形瓶,对测定盐酸体积产生的影响是 (填“偏高”、“偏低”或“无影响”)。
[实验分析]实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小。经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因。查阅资料发现:
Na2O2与水反应产生的H2O2未完全分解。
①写出Na2O2与水生成H2O2的化学方程式 。
②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案: 。
5、实验题 在实验室用氢气、一氧化碳、碳均可还原氧化铜。比较三个反应,并回答下列问题

(1)上述四种装置中,用于氢气还原氧化铜的装置是________,用于碳还原氧化铜的装置是________(填装置序号)。
(2)CO还原CuO若采用装置3,装置3中玻璃瓶内的溶液为澄清石灰水,反应开始后玻璃瓶中观察到的现象是________,产生这种现象说明____________。写出该现象的化学方程式:________________。
(3)CO还原CuO若采用装置4,装置4末端酒精灯的作用是_______________。