微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验操作或实验所得出的结论一定正确的是?(?)
A.加热NH4 Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成
B.制备Fe(OH)2胶体时,应往沸水中逐滴加1mol·L-1的FeCl3溶液,并继续加热到液体呈透明的红褐色为止
C.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
D.用托盘天平准确称取5. 85克NaCl
参考答案:B
本题解析:略
本题难度:简单
2、实验题 MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下:
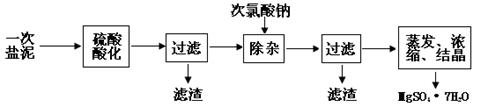
(1)用硫酸调整溶液pH到1~2,硫酸的作用是?。
 (2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是????(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:??。
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是????(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:??。
(3)若除杂后过滤,发现滤液发黄,需采取的措施是?。
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是?。
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时。为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→?。
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50g,用200mL水溶液,加入2mol·L-1HCl溶液5mL,将溶液加热至沸,在不断搅拌下逐滴加入5~6mL0.5mol·L-1BaCl2溶液,充分沉淀后,得沉淀0.466g,则样品中w(SO )=?。
)=?。
参考答案:

本题解析:略
本题难度:一般
3、实验题 课题式学习是研究性学习的一种基本方式,其学习模式为
某化学兴趣小组在学习了电解质的有关知识后,老师提出了一个“电解质水溶液导电能力的强弱的影响因素”的课题。让该小组来完成课题的研究,已知HCl在水中能完全电离。
(1)该小组同学首先用密度为1.049 g·cm-3的乙酸(CH3COOH)和质量分数为36.5%,密度为1.18 g·cm-3的浓盐酸分别配制1 mol/L CH3COOH溶液和1 mol/L HCl溶液各500 mL,则他们应该量取乙酸和浓盐酸的体积分别为_________和__________;
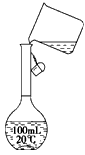
(2)某同学在配制500 mL 1 mol/L的CH3COOH溶液时,向容量瓶中转移溶液时操作如图所示,图中的错误有____________________
(3)他们首先用如下图所示装置测1 mol/L的CH3COOH溶液和1 mol/L HCl溶液的导电能力,接通电源后发现与HCl溶液相连的灯泡较亮,有同学认为乙酸是弱电解质,你__________(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是___________________________
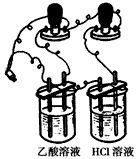
(4)他们又用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与
CuSO4溶液相连的灯泡较亮,有同学认为NaOH是弱电解质,你 ________(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是____________________________;
(5)通过上述探究实验,你能得到的结论是___________________________________。
参考答案:(1)28.6 mL;42.4 mL
(2)未用玻璃棒引流;未采用500 mL容量瓶
(3)同意;阴、阳离子带电荷数目相同时,单位体积内自由移动离子数目越大,电解质溶液的导电能力越强
(4)不同意;当单位体积内自由移动离子数目相同时,阴、阳离子带电荷数目越多,电解质溶液的导电能力越强
(5)电解质溶液的导电能力是由单位体积内自由移动离子数目和离子所带电荷数目共同决定
本题解析:
本题难度:一般
4、选择题 下列实验操作和结论错误的是( ? )
A.用新制Cu(OH)2悬浊液可鉴别麦芽糖和蔗糖
B.用银镜反应可证明蔗糖是否转化为葡萄糖,但不能证明是否完全转化
C.浓H2SO4可使蔗糖变黑,证明浓H2SO4具有脱水性
D.蔗糖溶液中滴加几滴稀H2SO4,水浴加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解
参考答案:D
本题解析:麦芽糖属于还原性糖,而蔗糖不是,A正确。B正确,产生银镜,只能说明水解生成来葡萄糖,但蔗糖是否剩余,则无法确定。浓硫酸具有脱水性,可使蔗糖炭化,C正确。发生银镜反应的条件是溶液显碱性,实验中没有用碱液中和硫酸是错误的。答案选D。
本题难度:简单
5、填空题 (1)现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO4?5H2O)的合理方案,只用化学方程式说明
第一步:______
第二步:______
第三步:过滤,加热浓缩,冷却结晶______
(2)有人建议用铜和稀硫酸混合在加热的条件下不断通入空气以制得硫酸铜溶液,请写出该反应的化学方程式______.
参考答案:(1)以废铜屑和废硫酸为原料,从原料的利用率和环保的角度分析,设计制取胆矾(CuSO4?5H2O)的方案应:铜与氧气反应生成氧化铜,再由氧化铜与硫酸反应生成硫酸铜,最后过滤,加热浓缩,冷却结晶可得CuSO4?5H2O.
故反应方程式为第一步:2Cu+O2?△?.?2CuO;
第二步:CuO+H2SO4=CuSO4+H2O;
第三步:CuSO4+5H2O=CuSO4?5H2O.
故答案为:2Cu+O2=2CuO;CuO+H2SO4=CuSO4+H2O;CuSO4+5H2O=CuSO4?5H2O.
(2)铜和稀硫酸混合在加热的条件下不断通入空气,反应生成硫酸铜与水,方程式为2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O.
故答案为:2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O.
本题解析:
本题难度:一般