| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《物质的量》答题技巧(2017年最新版)(二)
参考答案:A 本题解析:假设烧瓶的容积为VL。则氨水的容积为VL。n(NH3)=VL÷22.4L/mol=V÷22.4mol.所以氨水的浓度为C=n÷V= (V÷22.4mol)÷VL=1÷22.4mol/L="0.045" mol/L。因此选项为A。 本题难度:一般 2、实验题 (10分)某同学帮助水质检测站配制800mL 1 mol·L-1NaOH溶液备用。 |
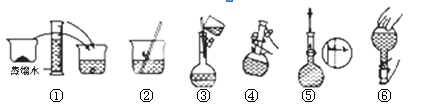
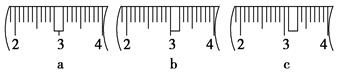
参考答案:(1) 1000mL容量瓶 (2) D (3) 40.0 、 C (4)① 偏小② 偏小③无影响 ④偏小 (5) 空气中的二氧化碳会和氢氧化钠反应 、小
本题解析:(1)配制一定物质的量浓度的溶液一定要用到容量瓶,容量瓶的规格没有800mL的,所以选用容量较大的,故还要1000mL容量瓶。(2)图示的操作是加入蒸馏水,这个操作是在移液之后,,摇匀之前,故选D。(3)选用1000mL容量瓶,故配制的溶液体积是1000mL,则n(NaOH)=cV=1 mol·L-1×1L=1.0mol,m(NaOH)=n×M=1.0mol×40g/mol=40.0g,称量时游码应该移到3.1 g的位置处,表示游码位置在3.1 g处的是C。(4)① 定容时,仰视读数,造成溶液的体积增大,浓度会偏小。② 转移溶液过程中,未洗涤玻璃棒和烧杯,会造成溶质有损失,浓度会偏小。③在配制过程中需要加水,故容量瓶未干燥,对浓度无影响。④ 定容摇匀后发现溶液凹面低于刻度线,继续加水至刻度线,会造成体积增大,浓度会偏小。(5)氢氧化钠会与空气中的二氧化碳反应,如果操作缓慢,会使得一部分氢氧化钠发生反应,导致配制的溶液浓度偏小。
考点:一定物质的量浓度溶液的配制。
本题难度:一般
3、选择题 标准状况下的2mol H2的体积为
A.11.2L
B.22.4L
C.33.6L
D.44.8L
参考答案:D
本题解析:略
本题难度:简单
4、选择题 NA表示阿伏加德罗常数值。下列说法正确的是
A.1mol Cu与足量稀硝酸反应产生NA个NO分子
B.标准状况下,2.24 L CHCl3的分子数为0.1 NA
C.t℃时,1L pH=6的纯水中,含1×10-6NA个OH-
D.向FeI2溶液中通入适量氯气,当有1mol Fe2+被氧化时,总共转移电子的数目为1 NA
参考答案:C
本题解析:根据电子的得失守恒可知,1mol Cu与足量稀硝酸反应产生2NA/3个NO分子,选项C不正确;标准状况下,CHCl3不是气体,不能适用于气体摩尔体积;亚铁离子的还原性弱于碘离子的,因此氯气首先氧化的是碘离子,所以选项D中总共转移电子的数目为3 NA,因此正确的答案选C。
本题难度:困难
5、选择题 设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,5.6L水含有的分子数为0.25NA
B.1molCl2发生反应时,转移的电子数一定是2NA
C.1L 1mol/L的HCl溶液中含Cl-数为NA
D.1mol Fe与足量盐酸反应,转移的电子数为3NA
参考答案:C
本题解析:水标准状况下为固体,所以标准状况下,5.6L水含有的分子数大于0.25NA,A错误;1molCl2如果发生歧化反应时,转移电子数不能确定,B错误;1mol Fe与足量盐酸反应,转移的电子数为2NA。答案选C。
考点:阿伏伽德罗常数
点评:阿伏伽德罗常数是历年高考的“热点”问题。多年来全国高考化学试题出现的几率为100%。这双因为它既考查了学生对物质的量与粒子数、质量、气体体积和物质的量浓度之间的关系,又可以与物质结构、盐类水解、弱电解质的电离等其他的概念性知识点结合成综合性习题。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《反应速率与.. | |