|
高考化学必考知识点《影响化学反应速率的因素》高频试题特训(2017年最新版)(十)
2017-07-10 19:03:56
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.增大压强,活化分子数增加,化学反应速率一定增大
B.升高温度,活化分子百分数增加,化学反应速率一定增大
C.活化分子间所发生的分子间的碰撞为有效碰撞
D.加入反应物,使活化分子百分数增加,化学反应速率增大
参考答案:A、增大压强,使浓度增大,活化分子浓度增加,化学反应素速率增大,故A错误;
B、升高温度,活化分子百分数增加,化学反应速率一定能够增大,故B正确;
C、活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞,故C错误;
D、加入反应物,活化分子百分数不变,但活化分子总数增加,化学反应速率增大,故D错误.
故选B.
本题解析:
本题难度:简单
2、选择题 用3g铁粉与30ml,3mol/L的盐酸反应制取氢气,若要加快产生氢气的速率 可采取措施是
A.改用浓H2SO4
B.改用6mol/L的盐酸
C.改用6mol/L的HNO3
D.改用6g的铁粉
|
参考答案:B
本题解析:
试题解析:改用浓硫酸,与锌反应生成二氧化硫气体,无氢气生成,故A错误;改用6mol/L的盐酸,浓度增大,则反应速率增大,故B正确;改用6mol/L的HNO3,由于硝酸具有强氧化性,不生成氢气,故C错误;改用6g的铁粉,固体的表面积、浓度不变,反应速率不变,故D错误.
考点:化学反应速率的影响因素
本题难度:一般
3、选择题 下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )
A.Cu能与浓硝酸反应,而不与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温、常压下不反应,放电时可反应
D.Cu与浓硫酸反应,而不与稀硫酸反应
参考答案:A
本题解析:要想说明反应物本身的性质是影响化学反应速率的决定性因素,则该实验事实应区别在反应物本身而不是外界因素,如浓度、压强、温度、催化剂等。其中选项B、D为浓度不同所致,选项C为反应条件不同所致,只有选项A是因浓硝酸与浓盐酸本身性质不同所致。
本题难度:一般
4、选择题 为了制取碘,可通过反应:2NO+O2==2NO2?NO2+2H+ +2I- ="=NO" + I2+H2O制得,NO在制碘过程中的作用是
A.还原剂
B.氧化剂
C.催化剂
D.反应物
参考答案:C
本题解析:根据反应观察可知反应前后NO的的量并没有发生变化,但参与了化学反应,所以起催化剂作用,答案是C。
本题难度:简单
5、填空题 (6分)(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择??(填序号)。
①1mL? 0.01 mol·L—1的碘水?②1mL? 0.001 mol·L—1的碘水
③4mL? 0.01 mol·L—1的Na2S2O3溶液?④4mL? 0.001 mol·L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算υ(S2O32—)=?
参考答案:(1)②③④(3分)(各1分,少1扣1,错1全扣)
(2)8.3×10—4mol·L—1·s—1(3分)
本题解析:(1)考查外界条件对反应速率的影响。根据反应的方程式可知,如果选择①,则在④中,Na2S2O3是不足的,碘水是过量的,因此溶液不褪色,正确的答案选②③④。
(2)根据方程式可知,消耗Na2S2O3的物质的量浓度是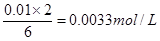 ,所以υ(S2O32—)= ,所以υ(S2O32—)= =8.3×10—4mol·L—1·s—1。 =8.3×10—4mol·L—1·s—1。
本题难度:简单
|